Геометрическая и оптическая изомерия. Изомеры, изомерия
Изомеры, изомерия
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства
Явление существования изомеров называется изомерией
Например, вещество состава С 4 Н 10 имеет два изомерных соединения.
Физические свойства бутана и изобутана отличаются: изобутан имеет более низкие температуры плавления и кипения, чем н.бутан.
Шаростержневая модель молекулы бутанаШаростержневая модель молекулы изобутана
Химические свойства данных изомеров различаются незначительно, т.к. они имеют одинаковые качественный состав и характер связи между атомами в молекуле.
По- другому определение изомеров можно дать так:
Изомеры – вещества, имеющие одинаковую молекулярную, но разную структурную формулу.
Виды изомерии
В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию.
Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением .
|
Структурная изомерия делится на: |
||
|
1.Изомерию углеродного скелета |
2.Изомерию положения (кратной связи, функциональной группы, заместителя) |
3.Межклассовую изомерию CH 3 -CH 2 -NO 2 нитроэтан HOOC-CH 2 -NH 2 аминоуксусная кислота (глицин) |
|
Изомерия положения |
||
|
кратной связи СН 2 = СН-СН= СН 2 СН 3 -СН= С= СН 2 |
функциональной группы СН 3 -СНОН -СН 3 СН 2 ОН -СН 2 -СН 3 |
Заместителя СН 3 -СНCI -СН 3 СН 2 CI -СН 2 -СН 3 |
Структурная изомерия
|
|
Изомерия положения кратной (двойной) связи: Бутен-1 и бутен -2 |
|
Изомерия углеродного скелета: Циклобутан и метилциклопропан |
|
|
Межклассовая изомерия: Бутен и циклобутан |
Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле
|
Пространственная изомерия делится на: |
|
|
|
Характерна для веществ, содержащих двойные связи или циклические. |
Оптические изомеры еще называют зеркальными или хиральными (как левая и правая рука)
Важное следствие жесткости двойной связи (отсутствия вращения вокруг нее) - существованиегеометрических изомеров . Самые распространенные из них - это цис-,транс-изомеры соединений этиленового ряда, содержащих у ненасыщенных атомов неодинаковые заместители. Простейшим примером могут служить изомеры бутена-2.
| цис-Бутен-2 | транс-Бутен-2 |
| Т.пл. -138.9 о С | -105.6 оС |
| Т.кип. 3.72 о С | 1.0 оС |
| d 0.724 | 0.604 |
| n D -20 1.3946 | 1.3862 |
Геометрические изомеры имеют одинаковое химическое строение, различаясь по пространственному расположению атомов, т.е. по конфигурации . Это различие и создает разницу в физических (а также химических свойствах). Геометрические изомеры, в отличие от конформеров, могут быть выделены в чистом виде и существуют как индивидуальные устойчивые вещества. Для их взаимного превращения необходима энергия порядка 125-170 кДж/моль, которую можно сообщить нагреванием или облучением.
В простейших случаях номенклатура геометрических изомеров не представляет затруднений:цис- формами называют геометрические изомеры, у которых одинаковые заместители лежат по одну сторону от плоскости пи-связи, транс- изомеры имеют одинаковые заместители на разных сторонах от плоскости пи-связи. В более сложных случаях применяется Z,E-номенклатура . Ее главный принцип: для обозначения конфигурации указывают цис- (Z, от немецкого Zusammen - вместе) или транс- (Е, от немецкого Entgegen - напротив) расположение старших заместителей при двойной связи.
В Z,E-системе старшими считаются заместители с большим атомным номером. Если атомы, непосредственно связанные с ненасыщенными углеродами, одинаковы, то переходят ко "второму слою", в случае необходимости - к "третьему слою" и т.д.
Рассмотрим применение правил Z,E-номенклатуры на двух примерах.
| I | II |
Начнем с формулы I, где все решается атомами "первого слоя". Расставив их атомные номера, получим, что старшие заместители каждой пары (бром в верхней части формулы и азот в нижней) находятся втранс -положении, отсюда следует стереохимические обозначение Е:
Е-1-бром-1-хлор-2-нитроэтен
Для определения стереохимического обозначения структуры II необходимо искать различие в "высших слоях". По первому слою группы СН 3 , С 2 Н 5 , С 3 Н 7 не отличаются. Во втором слое у группы СН 3 сумма атомных номеров равна трем (три атома водорода), у групп С 2 Н 5 и С 3 Н 7 - по 8. Значит, группа СН 3 не рассматривается - она младше двух других. Таким образом, старшие группы - это С 2 Н 5 и С 3 Н 7 , они находятся в цис -положении; стереохимическое обозначение Z.
Z-3-метилгептен-3
Если бы понадобилось определить, какая группа старше - С 2 Н 5 или С 3 Н 7 , пришлось бы перейти к атомам "третьего слоя", сумма атомных номеров в этом слое для обеих групп оказались бы соответственно равными 3 и 8, т.е. С 3 Н 7 старше, чем С 2 Н 5 . В более сложных случаях определения старшинства надо учитывать дополнительные условия, как-то: атом, связанный двойной связью, считается дважды, связанный тройной - трижды; из числа изотопов старше более тяжелый (дейтерий старше водорода) и некоторые другие.
Отметим, что обозначения Z не является синонимами цис- обозначений, как и обозначения Е не всегда соответствуют расположению транс- , например:

 I. Изомерия (от греч. isos - равный) Берцелиус, 1830 г. Изомеры - это вещества, которые имеют одинаковую молекулярную формулу (одинаковый качественный и количественный состав), но отличаются последовательностью связывания атомов и (или) расположением их в пространстве и обладают разными свойствами.
I. Изомерия (от греч. isos - равный) Берцелиус, 1830 г. Изомеры - это вещества, которые имеют одинаковую молекулярную формулу (одинаковый качественный и количественный состав), но отличаются последовательностью связывания атомов и (или) расположением их в пространстве и обладают разными свойствами.
 БЕРЦЕЛИУС (Berzelius), Йёнс Якоб 1779 г. – 1848 г. Знаменитый шведский химик. С 1807 профессор медицины и фармации в Стокгольме.
БЕРЦЕЛИУС (Berzelius), Йёнс Якоб 1779 г. – 1848 г. Знаменитый шведский химик. С 1807 профессор медицины и фармации в Стокгольме.
 С 2 Н 6 О диметиловый эфир Ткип= -24 С этиловый спирт Ткип= 78 С н-бутан Ткип= -0, 5 С С 4 Н 10 изобутан Ткип= -11, 7 С
С 2 Н 6 О диметиловый эфир Ткип= -24 С этиловый спирт Ткип= 78 С н-бутан Ткип= -0, 5 С С 4 Н 10 изобутан Ткип= -11, 7 С
 Число изомеров в ряду алканов Название Формула Число Формула изомеров Название Число изомеров CH 4 метан 1 C 11 H 24 ундекан 159 C 2 H 6 этан 1 C 12 H 26 додекан 355 C 3 H 8 пропан 1 C 13 H 28 тридекан 802 C 4 H 10 бутан 2 C 14 H 30 тетрадекан 1 858 C 5 H 12 пентан 3 C 15 H 32 пентадекан 4 347 C 6 H 14 гексан 5 C 20 H 42 эйкозан C 7 H 16 гептан 9 C 25 H 52 пентакозан 36 797 588 C 8 H 18 октан 18 C 30 H 62 триаконтан 4 111 846 763 C 9 H 20 нонан 35 C 40 H 82 тетраконтан 62 491 178 805 831 C 10 H 22 декан 75 366 319
Число изомеров в ряду алканов Название Формула Число Формула изомеров Название Число изомеров CH 4 метан 1 C 11 H 24 ундекан 159 C 2 H 6 этан 1 C 12 H 26 додекан 355 C 3 H 8 пропан 1 C 13 H 28 тридекан 802 C 4 H 10 бутан 2 C 14 H 30 тетрадекан 1 858 C 5 H 12 пентан 3 C 15 H 32 пентадекан 4 347 C 6 H 14 гексан 5 C 20 H 42 эйкозан C 7 H 16 гептан 9 C 25 H 52 пентакозан 36 797 588 C 8 H 18 октан 18 C 30 H 62 триаконтан 4 111 846 763 C 9 H 20 нонан 35 C 40 H 82 тетраконтан 62 491 178 805 831 C 10 H 22 декан 75 366 319
 II. Гомология Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся друг от друга по количеству групп -CH 2 - в углеродной цепи, составляют гомологический ряд. Гомологический ряд метана
II. Гомология Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся друг от друга по количеству групп -CH 2 - в углеродной цепи, составляют гомологический ряд. Гомологический ряд метана
 III. Изологические ряды. l l Это ряды веществ, построенных из того же числа атомов углерода, но отличающиеся количественным составом атомов Н, т. е. каждый следующий член ряда содержит на 2 атома Н меньше, чем предыдущий: С 2 Н 6 этан С 2 Н 4 этилен С 2 Н 2 ацетилен
III. Изологические ряды. l l Это ряды веществ, построенных из того же числа атомов углерода, но отличающиеся количественным составом атомов Н, т. е. каждый следующий член ряда содержит на 2 атома Н меньше, чем предыдущий: С 2 Н 6 этан С 2 Н 4 этилен С 2 Н 2 ацетилен






 Структурная изомерия 3. Таутомерия (прототропная или динамическая изомерия) Таутомери я (от греч. ταύτίς - тот же самый и μέρος - мера) - явление сосуществования двух изомерных форм, находящихся в подвижном равновесии и способных самопроизвольно переходить друг в друга.
Структурная изомерия 3. Таутомерия (прототропная или динамическая изомерия) Таутомери я (от греч. ταύτίς - тот же самый и μέρος - мера) - явление сосуществования двух изомерных форм, находящихся в подвижном равновесии и способных самопроизвольно переходить друг в друга.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="Конформация >С ------- С Конформация >С ------- С
 Геометрическая изомерия Геометрические изомеры – имеют одинаковый порядок (последовательность) связей в молекуле, но отличаются расположением атомов (групп) в пространстве относительно плоскости двойной связи или малого цикла.
Геометрическая изомерия Геометрические изомеры – имеют одинаковый порядок (последовательность) связей в молекуле, но отличаются расположением атомов (групп) в пространстве относительно плоскости двойной связи или малого цикла.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="Цис- и транс-изомеры бутена-2 У каждого атома >C=C Цис- и транс-изомеры бутена-2 У каждого атома >C=C
 «по сю и по ту сторону» реки Лейты Цислейтания – наименование земель австрийской короны; показано красным; 1867 -1918 г. Транслейтания - наименование земель венгерской короны; показано зелёным
«по сю и по ту сторону» реки Лейты Цислейтания – наименование земель австрийской короны; показано красным; 1867 -1918 г. Транслейтания - наименование земель венгерской короны; показано зелёным




 E, Z-номенклатура 2 1 Е-1 -нитро-1 -бром-2 -хлорпентен 1 2 Z-1 -нитро-1 -бром-2 -хлорпентен 1. Используя правила Кана-Ингольда-Прелога, определяют относительное старшинство заместителей, связанных двойной связью и дают им номера по старшинству 1 или 2.
E, Z-номенклатура 2 1 Е-1 -нитро-1 -бром-2 -хлорпентен 1 2 Z-1 -нитро-1 -бром-2 -хлорпентен 1. Используя правила Кана-Ингольда-Прелога, определяют относительное старшинство заместителей, связанных двойной связью и дают им номера по старшинству 1 или 2.
 а) Атом с большим атомным номером является старшим относительно атома с меньшим номером. б) Если два атома являются изотопами, то преимущество имеет атом с большим массовым числом. 2. Если две наиболее старшие группы расположены по одну сторону от плоскости π-связи, то конфигурация заместителей обозначается символом Z. (от немецкого zusammen вместе) Если же эти группы находятся по разные стороны от плоскости π-связи, то конфигурацию обозначают символом Е (от немецкого entgegen напротив)
а) Атом с большим атомным номером является старшим относительно атома с меньшим номером. б) Если два атома являются изотопами, то преимущество имеет атом с большим массовым числом. 2. Если две наиболее старшие группы расположены по одну сторону от плоскости π-связи, то конфигурация заместителей обозначается символом Z. (от немецкого zusammen вместе) Если же эти группы находятся по разные стороны от плоскости π-связи, то конфигурацию обозначают символом Е (от немецкого entgegen напротив)



 Луи Пастер (Louis Pasteur) (27. 12. 1822 -28. 09. 1895) Французский химик, величайший исследователь XIX столетия "Асимметрия - это то, что отличает органический мир от неорганического" (этот закон положил начало стереохимии). Асимметричные кристаллы обладают свойством вращать поляризованный свет.
Луи Пастер (Louis Pasteur) (27. 12. 1822 -28. 09. 1895) Французский химик, величайший исследователь XIX столетия "Асимметрия - это то, что отличает органический мир от неорганического" (этот закон положил начало стереохимии). Асимметричные кристаллы обладают свойством вращать поляризованный свет.
 Энантиомеры – пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение. (от греч. enantios – противоположный).
Энантиомеры – пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение. (от греч. enantios – противоположный).
 Хиральность (англ. chirality, от греч. chéir - рука), понятие в химии, характеризующее свойство объекта быть несовместимым со своим отображением в идеальном плоском зеркале.
Хиральность (англ. chirality, от греч. chéir - рука), понятие в химии, характеризующее свойство объекта быть несовместимым со своим отображением в идеальном плоском зеркале.






 Фишер (Fischer) Эмиль Герман (9. 10. 1852, Эйскирхен, – 15. 7. 1919, Берлин), немецкий химик-органик и биохимик.
Фишер (Fischer) Эмиль Герман (9. 10. 1852, Эйскирхен, – 15. 7. 1919, Берлин), немецкий химик-органик и биохимик.
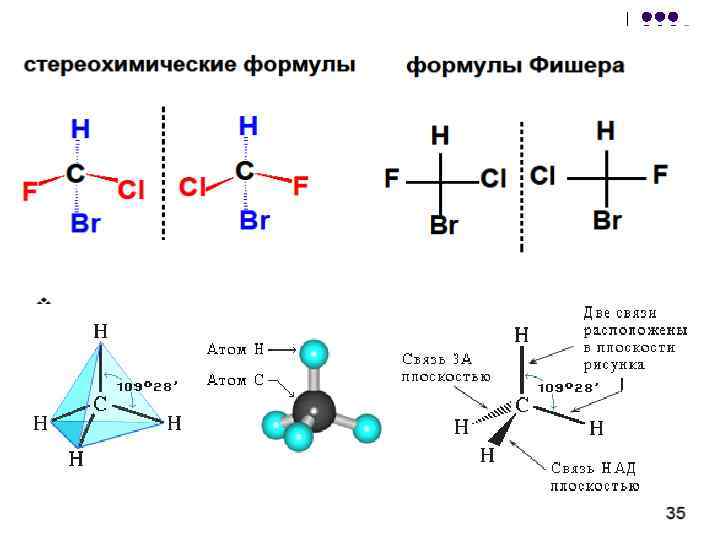


 Проекции Фишера можно преобразовать: l l 1. чётное число перестановок заместителей не меняет формулу; 2. нечётное число перестановок заместителей приводит к формуле антипода (энантиомера); 3. запрещается поворот формулы на 90 или 270 , а также выведение формулы из этой плоскости (эти действия приводят к формуле антипода); 4. допускается поворот всей формулы в плоскости чертежа на 180 ;
Проекции Фишера можно преобразовать: l l 1. чётное число перестановок заместителей не меняет формулу; 2. нечётное число перестановок заместителей приводит к формуле антипода (энантиомера); 3. запрещается поворот формулы на 90 или 270 , а также выведение формулы из этой плоскости (эти действия приводят к формуле антипода); 4. допускается поворот всей формулы в плоскости чертежа на 180 ;
 Относительная конфигурация 1906 г. , по предложению М. А. Розанова L- и D-изомеры (от латинских слов laevus – левый и dexter – правый).
Относительная конфигурация 1906 г. , по предложению М. А. Розанова L- и D-изомеры (от латинских слов laevus – левый и dexter – правый).



 Система Кана–Ингольда–Прелога? Роберт Сидни Кан Ингольд Кристофер Прелог Владимир (9. 06. 1899 -15. 09. 1981) (28. 10. 1893– 8. 10. 1970) (23. 07. 1906– 07. 01. 1998) (Великобритания) (Швейцария)
Система Кана–Ингольда–Прелога? Роберт Сидни Кан Ингольд Кристофер Прелог Владимир (9. 06. 1899 -15. 09. 1981) (28. 10. 1893– 8. 10. 1970) (23. 07. 1906– 07. 01. 1998) (Великобритания) (Швейцария)



 Общее число оптических изомеров определяется формулой N = 2 n , n число центров хиральности. I III IV 2 -амино-3 -гидроксибутановая кислота
Общее число оптических изомеров определяется формулой N = 2 n , n число центров хиральности. I III IV 2 -амино-3 -гидроксибутановая кислота
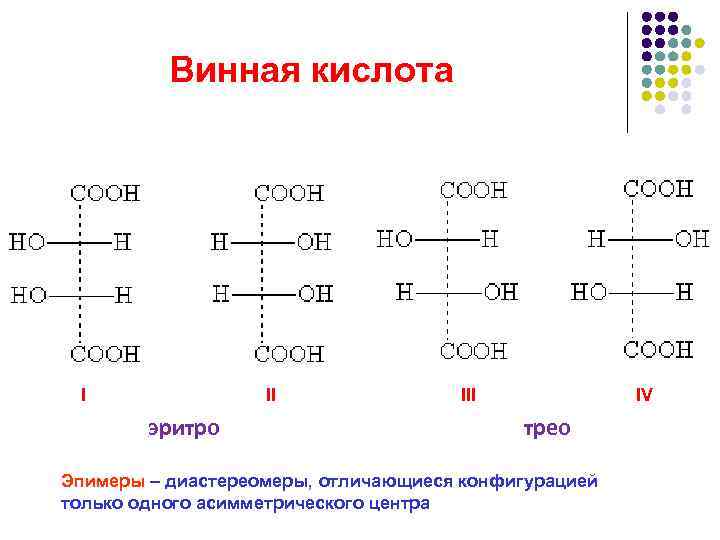 Винная кислота I III IV эритро трео Эпимеры – диастереомеры, отличающиеся конфигурацией только одного асимметрического центра
Винная кислота I III IV эритро трео Эпимеры – диастереомеры, отличающиеся конфигурацией только одного асимметрического центра

 Рацемат (от латинского racemus – виноград). При смешивании эквимолярных количеств D - и L - стереизомеров образуются оптически неактивные смеси, получившие название рацемических S (от лат. sinister – левый) и R (лат. rectus – правый); рацемат обозначают символом RS. Расщепление рацемических смесей: 1. Механический метод (метод Пастера). 2. Микробиологический метод 3. Ферментативный метод. 4. Химический метод. Афинная хроматография
Рацемат (от латинского racemus – виноград). При смешивании эквимолярных количеств D - и L - стереизомеров образуются оптически неактивные смеси, получившие название рацемических S (от лат. sinister – левый) и R (лат. rectus – правый); рацемат обозначают символом RS. Расщепление рацемических смесей: 1. Механический метод (метод Пастера). 2. Микробиологический метод 3. Ферментативный метод. 4. Химический метод. Афинная хроматография
 ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. Адреналин, эпинефрин ИЮПАК: 1 -(3, 4 -дигидроксифенил)-2 метиламиноэтанол - гормон мозгового слоя надпочечников животных и человека. Медиатор нервной системы холоднокровных. Из двух энантиомеров адреналина наибольшую фармакологическую активность проявляет R(-) адреналин.
ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. Адреналин, эпинефрин ИЮПАК: 1 -(3, 4 -дигидроксифенил)-2 метиламиноэтанол - гормон мозгового слоя надпочечников животных и человека. Медиатор нервной системы холоднокровных. Из двух энантиомеров адреналина наибольшую фармакологическую активность проявляет R(-) адреналин.

 ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. правовращающий изопропиладреналин (изадрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер.
ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. правовращающий изопропиладреналин (изадрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер.

 Диастереомеры – пространственные изомеры, молекулы которых НЕ относятся между собой как предмет и несовместимое с ним зеркальное отображение.
Диастереомеры – пространственные изомеры, молекулы которых НЕ относятся между собой как предмет и несовместимое с ним зеркальное отображение.

 Конформационная изомерия Конформационная изомерия возникает как результат различного расположения частей одной и той же молекулы друг относительно друга, достигаемого при вращении этих частей вокруг простой С-С связи, соединяющей два атома.
Конформационная изомерия Конформационная изомерия возникает как результат различного расположения частей одной и той же молекулы друг относительно друга, достигаемого при вращении этих частей вокруг простой С-С связи, соединяющей два атома.
 (от лат. conformatio - форма, расположение), различные пространственные формы, принимаемые молекулами в результате свободного вращения отдельных фрагментов вокруг простых С-С связей.
(от лат. conformatio - форма, расположение), различные пространственные формы, принимаемые молекулами в результате свободного вращения отдельных фрагментов вокруг простых С-С связей.







 69% 31% Ван-дер-Ваальсово напряжение – обусловлено силами отталкивания между валентно не связанными большими по объёму заместителями.
69% 31% Ван-дер-Ваальсово напряжение – обусловлено силами отталкивания между валентно не связанными большими по объёму заместителями.
В ходе урока вы получите общее представление о видах изомерии, узнаете, что такое изомер. Узнаете о видах изомерии в органической химии: структурной и пространственной (стереоизомерии). С помощью структурных формул веществ рассмотрите подвиды структурной изомерии (скелетную и изомерию положений), узнаете о разновидностях пространственной изомерии: геометрической и оптической.
Тема: Введение в органическую химию
Урок: Изомерия. Виды изомерии. Структурная изомерия, геометрическая, оптическая
Рассмотренные нами ранее виды формул, описывающих органические вещества, показывают, что одной молекулярной может соответствовать несколько разных структурных формул.
Например, молекулярной формуле C 2 H 6 O соответствуют два вещества с разными структурными формулами - этиловый спирт и диметиловый эфир. Рис. 1.
Этиловый спирт - жидкость, которая реагирует с металлическим натрием с выделением водорода, кипит при +78,5 0 С. При тех же условиях диметиловый эфир - газ, не реагирующий с натрием, кипит при -23 0 С.
Эти вещества отличаются своим строением - разным веществам соответствует одинаковая молекулярная формула.
Рис. 1. Межклассовая изомерия
Явление существования веществ, имеющих одинаковый состав, но разное строение и поэтому разные свойства называют изомерией (от греческих слов «изос» - «равный» и «мерос» - «часть», «доля»).
Типы изомерии
Существуют разные типы изомерии.
Структурная изомерия связана с разным порядком соединения атомов в молекуле.
Этанол и диметиловый эфир - структурные изомеры. Поскольку они относятся к разным классам органических соединений, такой вид структурной изомерии называется еще и межклассовой . Рис. 1.
Структурные изомеры могут быть и внутри одного класса соединений, например формуле C 5 H 12 соответствуют три разных углеводорода. Это изомерия углеродного скелета . Рис. 2.

Рис. 2 Примеры веществ - структурных изомеров
Существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или атомов, замещающих водород. Этот вид структурной изомерии называется изомерией положения .
Рис. 3. Структурная изомерия положения
В молекулах, содержащих только одинарные связи, при комнатной температуре возможно почти свободное вращение фрагментов молекулы вокруг связей, и, например, все изображения формул 1,2-дихлорэтана равноценны. Рис. 4

Рис. 4. Положение атомов хлора вокруг одинарной связи
Если же вращение затруднено, например, в циклической молекуле или при двойной связи, то возникает геометрическая или цис-транс изомерия. В цис-изомерах заместители находятся по одну сторону плоскости цикла или двойной связи, в транс-изомерах - по разные стороны.
Цис-транс изомеры существуют в том случае, когда с атомом углерода связаны два разных заместителя. Рис. 5.



Рис. 5. Цис- и транс- изомеры
Еще один тип изомерии возникает в связи с тем, что атом углерода с четырьмя одинарными связями образует со своими заместителями пространственную структуру - тетраэдр. Если в молекуле есть хотя бы один углеродный атом, связанный с четырьмя разными заместителями, возникает оптическая изомерия . Такие молекулы не совпадают со своим зеркальным изображением. Это свойство называется хиральностью - от греческого с hier - «рука». Рис. 6. Оптическая изомерия характерна для многих молекул, входящих в состав живых организмов.
|
|
|
Рис. 6. Примеры оптических изомеров
Оптическая изомерия называется также энантиомерией (от греческого enantios - «противоположный» и meros - «часть»), а оптические изомеры - энантиомерами . Энантиомеры оптически активны, они вращают плоскость поляризации света на один и тот же угол, но в противоположные стороны: d- , или (+)-изомер, - вправо, l- , или (-)-изомер, - влево. Смесь равных количеств энантиомеров, называемая рацематом , оптически недеятельна и обозначается символом d,l- или (±).
Подведение итога урока
В ходе урока вы получили общее представление о видах изомерии, что такое изомер. Узнали о видах изомерии в органической химии: структурной и пространственной (стереоизомерии). С помощью структурных формул веществ рассмотрели подвиды структурной изомерии (скелетную и изомерию положений), познакомились с разновидностями пространственной изомерии: геометрической и оптической.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2008. - 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2010. - 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. - 4-е изд. - М.: РИА «Новая волна»: Издатель Умеренков, 2012. - 278 с.
Домашнее задание
1. №№ 1,2 (с.39) Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Почему число изомеров у углеводородов ряда этилена больше, чем предельных углеводородов?
3. Какие углеводороды имеют пространственные изомеры?
Цис-транс -изомерия или геометрическая изомерия - один из видов стереоизомерии : заключается в возможности расположения заместителей по одну или по разные стороны плоскости двойной связи или неароматического цикла. Все геометрические изомеры относятся к диастереомерам , так как не являются зеркальными отражениями друг друга. Цис - и транс -изомеры встречаются как среди органических соединений, так и среди неорганических. Понятия цис и транс не используются в случае конформеров , двух геометрических форм, легко переходящих друг в друга, вместо них используются обозначения «син» и «анти».
Обозначения «цис » и «транс » произошли из латыни, в переводе с этого языка цис означает «на одной стороне» , а транс - «на другой стороне» или «напротив». Термин «геометрическая изомерия» согласно ИЮПАК считается устаревшим синонимом цис -транс -изомерии .
Следует помнить, что цис-транс -номенклатура описывает относительное расположение заместителей, и не следует путать её с E,Z -номенклатурой, которая даёт абсолютное стереохимическое описание и применяется только к алкенам .
Органическая химия
Цис-транс -изомерией проявляют также и алициклические соединения , у которых заместители могут располагаться по одну или по разные стороны плоскости кольца. В качестве примера можно привести 1,2-дихлорциклогексан:
 |
  |
| транс -1,2-дихлорциклогексан | цис -1,2-дихлорциклогексан |
Различие в физических свойствах
 |
 |
| цис -2-пентен | транс -2-пентен |
 |
 |
| цис -1,2-дихлорэтилен | транс -1,2-дихлорэтилен |
 |
 |
| цис
-бутендиовая кислота (малеиновая кислота) |
транс
-бутендиовая кислота (фумаровая кислота) |
 |
 |
| Олеиновая кислота | Элаидиновая кислота |
Отличия могут быть незначительными, как в случае температуры кипения алкенов с прямой цепью, таких как 2-пентен , цис -изомер которого кипит при 37 °C, а транс -изомер - при 36 °C . Разница между цис - и транс - становится ещё больше, если в молекуле есть поляризованные связи, как в 1,2-дихлорэтилене . Цис -изомер в данном случае кипит при 60,3 °C, а вот транс -изомер закипает при 47,5 °C . В случае цис -изомера эффект от двух полярных связей C-Cl складываются, образуя сильный молекулярный диполь , что даёт начало сильным межмолекулярным взаимодействиям (силам Кеезома), которые добавляются к дисперсионным силам и приводит к увеличению точки кипения. В транс -изомере, напротив, подобного не происходит, поскольку два момента C−Cl связей расположены друг напротив друга и аннулируют друг друга, не создавая дополнительный дипольный момент (хотя их квадрупольный момент совсем не равен нулю).
Два геометрических изомера бутендиовой кислоты настолько сильно отличаются по своим свойствам и реакционной способности, что даже получили разные названия: цис -изомер называется малеиновая кислота , а транс -изомер - фумаровая кислота . Ключевое свойство, определяющее относительную температуру кипения, - полярность молекулы, так как она усиливает межмолекулярные взаимодействия, тем самым повышая температуру кипения. В такой же манере симметрия определяет температуру плавления, поскольку симметричные молекулы лучше упаковываются в твёрдом состоянии, даже если полярность молекулы не меняется. Один из примеров такой зависимости - олеиновая и элаидиновая кислоты; олеиновая кислота, цис -изомер, имеет температуру плавления в 13,4 °C, и при комнатной температуре становится жидкостью, в то время как транс -изомер, элаидиновая кислота, обладает более высокой температурой плавления в 43 °C, поскольку более прямой транс -изомер имеет более плотную упаковку и остаётся твёрдым при комнатной температуре.
Цис-транс -изомеры дикарбоновых кислот различаются и по кислотности: малеиновая кислота (цис ) является значительно более сильной кислотой, чем фумаровая (транс ). Так, первая константа диссоциации для фумаровой кислоты pК a1 = 3,03, а для малеиновой кислоты pK a1 = 1,9. Наоборот, константа диссоциации второй карбоксильной группы для фумаровой кислоты больше, чем для малеиновой, а именно: для фумаровой кислоты pK a2 = 4,44, а для малеиновой кислоты pK a2 = 6,07. Благодаря пространственной близости карбоксильных групп в цис -форме увеличивается склонность водорода к ионизации, поэтому первая константа малеиновой кислоты оказывается больше. Однако второму протону труднее преодолеть притяжение двух сближенных карбоксильных групп в цис -изомере, поэтому вторая константа диссоциации малеиновой кислоты меньше, чем у фумаровой . Аналогичный принцип действует и для алициклических дикарбоновых кислот, однако с увеличением размера кольца следует также учитывать влияние неплоской формы цикла .
Вицинальная константа ядерной спин-спиновой связи (3 J HH), измеряемая при помощи ЯМР-спектроскопии , больше для транс -изомеров (диапазон: 12-18 Гц; в среднем: 15 Гц), чем для цис -изомеров (диапазон: 0-12 Гц; в среднем: 8 Гц) .
Стабильность
Как правило для ациклических систем транс цис . Причина этого обычно заключается в усилении нежелательных стерических взаимодействиях близко расположенных заместителей в цис -изомере. По этой же причине удельная теплота сгорания транс -изомеров ниже чем у цис , что указывает на большую термодинамическую стабильность . Исключением из этого правила являются 1,2-дифторэтилен, 1,2-дифтордиазен (FN=NF), 1-бромпропен-1 и несколько других галоген- и кислород-замещённых этиленов . В данном случае цис -изомер оказывается более стабильным, чем транс -изомер поскольку между такими заместителями преобладают не силы отталкивания, а силы притяжения (типа сил Лондона). К тому же благодаря относительно небольшому объёму заместителей не возникает стерических затруднений . Из 1,2-дигалогенэтиленов только у 1,2-дийодэтилена транс-изомер стабильнее, чем цис -изомер, поскольку из-за большого радиуса атомы йода испытывают сильное пространственное взаимодействие, если находятся по одну сторону двойной связи .
Взаимопревращение изомеров
Геометрические изомеры, различие которых связано с положением заместителей вокруг двойной связи, отличаются от стереоизомерных форм иного типа - конформеров . Раздельное существование цис - и транс -изомеров в сущности возможно лишь благодаря высокому энергетическому барьеру вращения вокруг двойной связи, что делает возможным раздельное существование цис - и транс -изомеров, в то время как конформеры существуют только в виде равновесной смеси. Величина барьера вращения вокруг двойной связи в простых алкенах составляет 250-270 кДж/моль. Однако, если поставить с одной стороны сильные доноры электронов (-SR), а с другой - группы, сильные акцепторы электронов (-CN, -COC 6 H 5), поляризовав таким образом двойную связь, то это приведёт к существенному снижению барьера вращения. Барьер вращения вокруг поляризованной таким образом связи может быть снижен до 60-100 кДж/моль. Низкие энергетические барьеры, когда энергетическая разница между цис-транс -изомерами и конформерами сглаживается, обнаружены для аминопроизводных ацетоуксусного эфира и енаминокетонов. Показано, что в таких системах положение равновесия зависит от природы растворителя. Так, енаминокетоны в неполярных растворителях на 100 % существуют в цис -форме, стабилизированной внутренней водородной связью, а в полярных растворителей появляется до 50 % транс -формы .
E,Z -номенклатура
Система обозначений цис -транс хорошо применима только для именования изомерных алкенов с двумя разными видами заместителей при двойной связи, в сложных молекулах такая номенклатура становится слишком неопределённой. В этих случаях используют разработанную ИЮПАК E ,Z -систему обозначений, которая однозначно определяет название соединений для всех возможных случаев, а потому особенно полезна для именования три- и тетразамещённых алкенов. Такая система позволяет избежать путаницы касательно того какие группы следует считать цис - или транс - по отношению к друг другу.
Если две старшие группы расположены по одну сторону двойной связи, то есть находятся в цис -положении друг к другу, то такое вещество называют Z -изомером (от нем. zusammen - вместе). Когда же старшие группы расположены по разные стороны двойной связи (в транс -ориентации), то такой изомер называют E -изомером (от нем. entgegen - напротив). Порядок старшинства групп и атомов определяется по правилам Кана - Ингольда - Прелога . Для каждого из двух атомов в двойной связи необходимо определить старшинство каждого заместителя. Если оба старших заместителя расположены по одну сторону от плоскости π-связи , то такую конфигурацию обозначают символом Z , если же эти группы находятся по разные стороны от плоскости π-связи, то конфигурацию обозначают символом E .
Следует отметить, что цис /транс и E ,Z -номенклатуры опираются на сравнение разных заместителей алкенов, поэтому Z -изомер не всегда соответствует цис -изомеру, а E -изомер - транс -изомеру. Например, транс -2-хлорбутен-2 (две метильных группы C1 и C4, на главной цепи бутена-2а находятся в транс -ориентации) является (Z )-2-хлорбутеном-2 (хлор старше, чем метил, который в свою очередь старше водорода, поэтому хлор и C4-метил рассматриваются как расположенные вместе).
В неорганической химии
Цис –транс -изомерия встречается и в неорганических соединениях, в первую очередь в диазенах и комплексных соединениях .
Диазены
Диазены (и схожие с ними дифосфены) проявляют цис-транс- изомерию. Как и в случае органических соединений, цис -изомер более реакционноспособен, только он способен восстанавливать алкены и алкины до алканов . Транс -изомер, сближаясь с алкеном, не может выстроить свои атомы водорода в линию для эффективного восстановления алкена, а цис -изомер благодаря соответствующей форме успешно справляется с этой задачей.
  |
  |
| транс -диазен | цис -диазен |
Комплексные соединения
Неорганические координационные соединения с октаэдрической или плоской квадратной геометрией также подразделяются на цис -изомеры, в которых одинаковые лиганды расположены рядом, и транс -изомеры, в которых лиганды отстоят друг от друга.
Например, два геометрических изомера плоского квадратного строения существуют для Pt(NH 3) 2 Cl 2 , феномен, который Альфред Вернер объяснил в 1893 году. Цис -изомер с полным названием цис -дихлородиамминплатина(II) обладает противоопухолевой активностью, что было продемонстрировано Барнеттом Розенбергом в 1969 году. Сейчас это вещество известно в химиотерапии под коротким названием цисплатин . Транс -изомер (трансплатин), напротив, не обладает какой-либо лекарственной активностью. Каждый из этих изомеров можно синтезировать, опираясь на транс-эффект , что позволяет получить преимущественно нужный изомер.
 |
 |
|
цис - + и транс - + |
||
Для октаэдрических комплексов с формулой MX 4 Y 2 тоже существуют два изомера. (Здесь M - атом металла, а X и Y - лиганды разных видов.) В цис -изомере два лиганда Y примыкают друг к другу под углом 90°, как и показано для атомов хлора в цис - + на левой картинке. В транс -изомере, показанном справа, два атома хлора расположены на противоположных концах диагонали, проходящей через центральный атом кобальта.
Схожий тип изомерии октаэдральных комплексов состава MX 3 Y 3 - это гран-ос -изомерия, или гранево-осевая изомерия, когда некоторое количество лигандов оказываются в цис - или транс -положении друг к другу. В гран -изомерах лиганды одного типа занимают вершины треугольной грани октаэдра, а в ос -изомерах эти же лиганды находятся в трёх соседних позициях так, что два лиганда оказываются по разные стороны от центрального атома и на одной оси с ним





