Определение индивидуальной совместимости крови. Пробы на совместимость при проведении гемотрансфузии
Подробности
При переливании крови врач обязан выполнить следующие действия:
1. Определить показания к гемотрансфузии, выявить противопоказания, собрать трансфузиологический анамнез.
2. Определить группу крови и резус-фактор реципиента.
3. Выбрать соответствующую (одногруппную и однорезусную) кровь и макроскопически оценить ее годность.
4. Перепроверить группу крови донора (из флакона) по системе АВО.
5. Провести пробу на индивидуальную совместимость по системе АВО.
6. Провести пробу на индивидуальную совместимость по резус-фактору.
7. Провести биологическую пробу.
8. Произвести гемотрансфузию.
9. Заполнить документацию.
СБОР ТРАНСФУЗИ0Л0ГИЧЕСК0Г0 АНАМНЕЗА
Необходимо выяснить у пациента, знает ли он свою группу и резус-фактор (используются как дополнительные сведения), были ли в прошлом переливания крови и ее компонентов, не было ли при этом каких-либо осложнений. У женщин необходимо выяснить наличие беременностей и их осложнений (особенно у резус-отрицательных женщин).
МАКРОСКОПИЧЕСКАЯ ОЦЕНКА ГОДНОСТИ КРОВИ
При визуальном контроле необходимо отметить:
■ Правильность.
■ Срок годности.
■ Герметичность упаковки.
■ Кровь должна быть разделена на три слоя (внизу красные эритроциты, выше узкая серая полоса лейкоцитов и тромбоцитов, над ними - желтая прозрачная плазма).
■ Плазма должна быть прозрачной, не содержать пленок и хлопьев (инфицированная кровь), а также сгустков, не иметь красной окраски (гемолиз).
Если при макроскопической оценке хотя бы одно из представленных требований не выполнено, такую кровь переливать нельзя.
ПРОБЫ НА ИНДИВИДУАЛЬНУЮ СОВМЕСТИМОСТЬ
Предварительно для постановки реакций у реципиента из вены берут кровь, которую разделяют на сгусток и сыворотку (отстаиванием или центрифугированием).
а) Проба на индивидуальную совместимость по системе АВО
На белую поверхность наносят крупную каплю (0,1 мл) сыворотки крови реципиента и маленькую капельку (0,01 мл) крови донора из флакона и смешивают их между собой, периодически покачивая тарелку. Реакция проводится при температуре 15-25°С, результаты оценивают через 5 минут: отсутствие агглютинации эритроцитов донора свидетельствует о совместимости крови донора и реципиента по системе АВО. Появление агглютинации указывает на их несовместимость - такую кровь данному больному переливать нельзя.
б) Проба на индивидуальную совместимость по резус-фактору
После того как установлена совместимость крови донора и реципиента по системе АВО, необходимо установить совместимость в отношении резус-фактора. Проба на совместимость по резус-фактору может быть проведена в одном из двух вариантов:
■ проба с использованием 33% полиглюкина,
■ проба с использованием 10% желатина.
В клинической практике наибольшее распространение получила проба с полиглюкином.
Проба с использованием 33% полиглюкина
Реакция проводится в центрифужной пробирке без подогрева в течение 5 минут. На дно пробирки вносят 2 капли сыворотки реципиента, 1 каплю донорской крови и 1 каплю 33% раствора полиглюкина. После этого содержимое перемешивают, наклоняя пробирку и вращая ее вокруг оси, распределяя содержимое по стенкам ровным слоем. Пробирку вращают в течение 5 минут, после чего добавляют 3-4 мл физиологического раствора и аккуратно перемешивают, 2-3 раза наклоняя пробирку до горизонтальной плоскости (не взбалтывая!). После этого оценивают результат: наличие агглютинации эритроцитов свидетельствует о несовместимости крови донора и реципиента по резус-фактору, такую кровь переливать нельзя. Равномерное окрашивание содержимого в пробирке, отсутствие реакции агглютинации указывает на совместимость крови донора и реципиента по резус-фактору.
Проба с использованием 10% желатина
На дно пробирки помещают 1 каплю эритроцитов донора, предварительно отмытых десятикратным объемом физиологического раствора, затем добавляют 2 капли подогретого до разжижения 10% раствора желатина и 2 капли сыворотки реципиента.
Содержимое пробирки перемешивают и помещают в водяную баню при температуре 46-48 С на 10 минут. После этого в пробирку добавляют 6-8 мл физиологического раствора, перемешивают содержимое, переворачивая пробирку 1-2 раза и оценивают результат: наличие агглютинации свидетельствует о несовместимости крови донора и реципиента, ее переливание недопустимо.
Если содержимое пробирки остается равномерно окрашенным и в ней не наблюдается реакция агглютинации, кровь донора совместима с кровью реципиента по резус-фактору.
У некоторых реципиентов (при наличии неполных скрытых или блокирующих антител, низкой активности иммунных антител) указанные пробы не выявляют несовместимости. В этих случаях проводится индивидуальный подбор крови донора.
Индивидуальный подбор донорской крови необходим следующим группам реципиентов:
1. Изоиммунизированным предшествующими гемотрансфузиями или беременностями.
2. Перенесшим гемотрансфузионное осложнение.
3. Нуждающимся в массивной гемотрансфузии.
4. При невозможности подобрать совместимую кровь обычными пробами на совместимость.
БИОЛОГИЧЕСКАЯ ПРОБА
Существует большое количество второстепенных групповых систем, которые могут стать причиной развития осложнений. Для исключения этой возможности в начале гемотрансфузии проводится еще одна проба на совместимость - биологическая проба.
Вначале струйно переливают 10-15 мл крови, после чего трансфузию прекращают (перекрывают капельницу) и в течение 3-х минут наблюдают за состоянием больного. При отсутствии клинических проявлений реакции или осложнения (учащение пульса, дыхания, появление одышки, затрудненное дыхание, гиперемия лица и т. д.) вводят вновь 10-15 мл крови и в течение 3 минут снова наблюдают за больным. Так повторяют трижды.
Отсутствие реакций у больного после трехкратной проверки являтся признаком совместимости вливаемой крови и служит основанием для осуществления всей гемотрансфузии.
При несовместимости крови донора и реципиента во время биологической пробы поведение пациента становится беспокойным: появляется тахикардия, одышка, гиперемия лица, ощущение озноба или жара, стеснение в груди, боли в животе и очень важный признак - боли в поясничной области.
При появлении этих признаков кровь считают несовместимой и гемотрансфузию не проводят.
ОСУЩЕСТВЛЕНИЕ ГЕМОТРАНСФУЗИИ
При отсутствии признаков биологической несовместимости начинают капельное переливание крови. Перед трансфузией флакон с переливаемой кровью должен находиться при комнатной температуре в течение 30-40 мин, а в экстренных ситуациях его подогревают до 37°С в водяной бане. Переливание проводят с помощью одноразовой системы для переливания крови с фильтром обычно со скоростью 40-60 капель в минуту.
В течение гемотрансфузии продолжается наблюдение за состоянием больного. После переливания контейнер с остатками трансфузионной среды (около 15 мл) и сыворотка реципиента хранятся в течение 2-х суток в холодильнике, чтобы можно было провести анализ гемотран-сфузионных осложнений в случае их развития.
ЗАПОЛНЕНИЕ ДОКУМЕНТАЦИИ
После окончания трансфузии врач записывает в историю болезни про-токол переливания крови:
■ показания к трансфузии,
■ паспортные данные с каждого флакона: фамилия донора, группа крови, резус-принадлежность, номер флакона, дата заготовки крови,
■ группа крови и Rh-фактор реципиента и донора,
■ результаты проб на индивидуальную совместимость крови доно¬ра и реципиента по системе АВО и Rh-фактору,
■ результат биологической пробы,
■ наличие реакций и осложнений,
■ дата, фамилия врача, переливавшего кровь, подпись.
НАБЛЮДЕНИЕ ЗА БОЛЬНЫМ ПОСЛЕ ГЕМОТРАНСФУЗИИ
Реципиент после переливания крови соблюдает в течение 2-х часов постельный режим и наблюдается лечащим и дежурным врачом в течение суток. Особенно тщательное наблюдение проводится в течение первых трех часов после гемотрансфузии. Оценивается наличие жалоб, изменение общего состояния, каждый час измеряется температура тела, частота пульса и артериальное давление. Необходимо макроскопически оценить первую порцию мочи после переливания крови, обращают внимание на сохранение мочеотделения и окраску мочи.
На следующий день обязательно выполнение клинического анализа крови и общего анализа мочи.
ПРОБЫ НА ИНДИВИДУАЛЬНУЮ СОВМЕСТИМОСТЬ КРОВИ ДОНОРА И РЕЦИПИЕНТА
Целью пробы на индивидуальную совместимость является предотвращение трансфузий несовместимых эритроцитов. Тестирование сыворотки реципиента с эритроцитами предполагаемого донора - наиболее надежный способ выявления антител, способных вызвать повреждение перелитых эритроцитов, посттрансфузионные реакции, в том числе и гемолитические. Проведение такой пробы позволяет:
- подтвердить АВО совместимость донора и реципиента;
- выявить все антитела в сыворотке реципиента, направленные против антигенов эритроцитов донора.
Проба на индивидуальную совместимость крови по антигенам системы АВО
Ход определения:
- на чистую сухую поверхность планшета или пластинки при комнатной температуре наносят и смешивают в соотношении 10:1 сыворотку реципиента и кровь донора;
- периодически покачивая планшет, наблюдают за ходом реакции;
- при отсутствии агглютинации в течение 5 мин кровь совместима. Наличие агглютинации указывает на несовместимость крови реципиента и донора. Такую кровь переливать нельзя. В сомнительных случаях результат пробы контролируют под микроскопом: при наличии "монетных столбиков", исчезающих после добавления теплого (+37°С) 0,9% раствора хлорида натрия, кровь совместима; если в капле смеси видны агглютинаты, не расходящиеся при добавлении теплого 0,9% раствора хлорида натрия,- кровь несовместима.
Проба на совместимость крови по антигенам системы резус с применением 33% раствора полиглюкина
Поскольку чувствительность этой пробы низкая, применять ее в стационарных лечебных учреждениях не рекомендуется. Допускается выполнение пробы на совместимость с применением 33% раствора полиглюкина при необходимости проведения переливания крови в экстремальных условиях.
Проба на совместимость по антигенам системы резус не заменяет, а дополняет пробу на совместимость по антигенам системы АВО.
Ход определения:
- на дно маркированной пробирки вносят 2 капли сыворотки больного, одну каплю донорской крови и одну каплю 33% раствора полиглюкина;
- перемешивают содержимое пробирки встряхиванием;
- медленно поворачивают пробирку так, чтобы содержимое растекалось по стенкам пробирки. При этом увеличивается выраженность реакции агглютинации;
- через 5 мин добавляют 2-3 мл физиологического раствора;
- перемешивают содержимое, 2-3 раза аккуратно перевертывая пробирку, не взбалтывая;
- наличие агглютинации в пробирке указывает, что кровь донора несовместима с кровью пациента и поэтому не может быть ему перелита. Если содержимое пробирки остается равномерно окрашенным, и не наблюдается признаков агглютинации эритроцитов - кровь совместима.
Проба на индивидуальную совместимость крови с применением центрифугирования
Ход определения:
- помещают 2 капли сыворотки реципиента на дно маркированной пробирки;
- добавляют 1 каплю 5% взвеси трижды отмытых эритроцитов донора в растворе низкой ионной силы - РНИС (при отсутствии РНИС можно использовать физиологический раствор, в этом случае ухудшается фиксация антител). Методика приготовления 5% взвеси трижды отмытых эритроцитов приведена в описании постановки непрямой пробы Кумбса;
- сразу после смешивания эритроцитов донора и сыворотки реципиента центрифугируют образец в течение 15-20 с при 2000 об./мин;
- аккуратно покачивая пробирку, ресуспендируют клеточный осадок и визуально определяют наличие агглютинатов. Наличие гемолиза и/или агглютинатов может означать:
- а) несовместимость по системе АВО;
- б) присутствие в сыворотке реципиента полных холодовых антител иной специфичности (анти-М, анти-N, анти-S и др).
Проба на индивидуальную совместимость крови с использованием раствора желатина
Необходимо использовать чистый, без хлопьев, прозрачный желатин, застывающий при температуре +4°С. Желатин нельзя замораживать. Для исключения неспецифической агглютинации эритроцитов раствором желатина целесообразно проверять каждую серию желатина в контроле с несенсибилизированными эритроцитами.
Ход определения:
- подогревают 10% раствор желатина в водяной бане до разжижения (+46-48°С) в течение 10 мин;
- к смеси эритроцитов донора и сыворотки реципиента (в соотношении 1:2) добавляют 2 капли подогретого 10% раствора желатина и тщательно перемешивают;
- в течение 10 мин инкубируют пробирку при +46-48°С на водяной бане или в течение 30 мин - в термостате;
- добавляют 5-8 мл физиологического раствора и аккуратно перемешивают, 1-2 раза перевертывая пробирку;
- визуально определяют наличие или отсутствие агглютинации эритроцитов. При отрицательном результате переносят каплю взвеси эритроцитов из пробирки на предметное стекло и микроскопируют при малом увеличении.
В качестве отрицательного контроля используют следующие пробы:
- а) смесь эритроцитов донора с желатином и 0,9% раствором хлорида натрия (в соотношении 1:2:2);
- б) смесь эритроцитов и сыворотки реципиента с желатином (в соотношении 1:2:2).
Проба на индивидуальную совместимость крови с использованием антиглобулинового реагента
Нельзя производить повторное замораживание-оттаивание антиглобулинового реагента. Для контроля качества антиглобулинового реагента целесообразно провести антиглобулиновый тест с резус-положительными эритроцитами, сенсибилизированными IgG (неполными) анти-D-антителами.
Ход определения:
Проводят пробу на индивидуальную совместимость крови с применением центрифугирования. Если не выявлено гемолиза, и эритроциты образовали гомогенную суспензию после встряхивания пробирки:
- инкубируют пробирку при 37°С в течение: 15 мин при использовании РНИС, либо 45 мин при использовании физиологического раствора;
- центрифугируют пробирку в течение 15- 20 с при 2000-3000 об./мин;
- визуально определяют наличие гемолиза в надосадочной жидкости;
- аккуратно покачивая пробирку, ресуспендируют клеточный осадок и визуально определяют наличие агглютинатов. Наличие гемолиза и/или агглютинатов свидетельствует об имеющихся у реципиента полных тепловых антителах к антигенам эритроцитов донора;
- при отсутствии гемолиза и агглютинации тщательно 3-4 раза отмывают эритроциты, каждый раз используя 5-10 мл физиологического раствора;
- удаляют физиологический раствор;
- добавляют 1-2 каплю антиглобулинового реагента к осадку эритроцитов и тщательно перемешивают;
- центрифугируют 15-20 с при 2000- 3000 об./мин;
- аккуратно ресуспендируют осадок эритроцитов и визуально определяют наличие или отсутствие агглютинации;
- визуально определяют наличие или отсутствие агглютинации эритроцитов.
При отрицательном результате переносят каплю взвеси эритроцитов из пробирки на предметное стекло и микроскопируют при малом увеличении.
При выявлении агглютинации кровь донора и реципиента несовместима по антигенам эритроцитов.
В качестве отрицательных контрольных проб используют:
- смесь 5% взвеси тест-эритроцитов с 0,9% раствором хлорида натрия (в соотношении 1:2) - контроль на спонтанную агглютинацию;
- смесь 5% взвеси тест-эритроцитов с анти-глобулиновым реагентом (в соотношении 1:2) - контроль аутосенсибилизации.
Контроль активности антиглобулинового реагента (всегда положительная реакция) - смесь 5% взвеси донорских эритроцитов группы 0(I) D + , сенсибилизированных антирезусной сывороткой (содержащей анти-D-антитела класса IgG) и антиглобулинового реагента (в соотношении 1:2).
Контроль специфичности антиглобулинового реагента (всегда отрицательная реакция) - смесь 5% взвеси донорских эритроцитов группы 0(I) D - (после инкубации с антирезусной сывороткой в течение 45 мин) и антиглобулинового реагента (в соотношении 1:2).
Антиглобулиновый реагент хранят замороженным при -20°С (сухой реагент можно хранить при комнатной температуре). Недопустимо повторное замораживание-оттаивание реагента.
Причины ложноположительных результатов:
- присутствие аутоантител на поверхности тест-эритроцитов;
- тест-эритроциты содержат микробные примеси;
- нарушение режима центрифугирования (механическое повреждение мембраны эритроцитов при чрезмерной нагрузке).
Причины ложноотрицательных результатов:
- тест-эритроциты плохо отмыты, или остатки белков сыворотки присутствуют на стенках пробирки;
- нарушение режимов отмывания или инкубации;
- потеря активности сыворотки или тест-эритроцитов в процессе хранения;
- низкая активность антиглобулинового реагента;
- недостаточное время инкубации.
| Страница
Источник : Медицинская лабораторная диагностика, программы и алгоритмы. Под ред. проф. Карпищенко А.И., СПб, Интермедика, 2001 |
При переливании эритроцитсодержащих компонентов крови, помимо определения группы крови и резус-фактора, проводятся две пробы, позволяющие выявить у реципиента наличие полных и неполных антител к эритроцитам донора. Кроме того, в обязательном порядке проводится трехкратная биологическая проба.
При переливании плазмы и ее препаратов выполняется только трехкратная биологическая проба.
При переливании больному компонентов крови из нескольких флаконов или контейнеров, пробы на совместимость должны быть сделаны с содержимым каждого флакона или контейнера, даже если на них указано, что кровь получена от одного и того же донора.
Проба на выявление полных антител
Ранее именовалась «Проба на индивидуальную совместимость», «Холодовая проба». Позволяет выявить агглютинины к антигенам систем АВО, MNSs,Lewisи др.
Проба выполняется с сывороткой крови реципиента, которую получают путем центрифугирования или отстаивания крови. Сыворотка годна к употреблению при условии ее хранения в холодильнике при температуре +4ºС не более 2-х дней.
На белую пластинку наносят 2-3 капли сыворотки крови больного, к которой добавляют в 5 раз меньшую каплю крови или эритроцитарной массы донора (из контейнера) - соотношение крови и сыворотки получается приблизительно 1:10. Стеклянной палочкой с оплавленным концом перемешивают кровь с сывороткой, затем пластинку покачивают в течение 5 мин., наблюдая за ходом реакции. По истечении указанного времени в реагирующую смесь рекомендуется добавить 1-2 капли физиологического раствора для ликвидации «ложной агглютинации».
Отсутствие агглютинации свидетельствует о совместимости крови донора и реципиента, а появление агглютинации указывает на их несовместимость и недопустимость переливания этой крови.
Проба на выявление неполных антител
Ранее именовалась «Проба на совместимость по Rh-фактору»,«Тепловая проба».
Может осуществляться несколькими способами. Наиболее чувствительной является непрямая проба Кумбса. Однако ее выполнение достаточно сложно, требует специального реактива (антирезусная сыворотка) и значительного времени (около 2 часов). Вследствие этого проба Кумбса выполняется только в условиях лаборатории по специальным показаниям, для индивидуального подбора крови «сложным» реципиентам. Несколько уступает ей в точности, но технически легче осуществима проба с 10% раствором желатина на водяной бане. Проба с 33% раствором полиглюкина технически наиболее простая и быстрая, но и наименее точная. Для нужд практического здравоохранения наиболее подходящей является проба с 10% раствором желатина на водяной бане.
Проба на совместимость по Rh-фактору с использованием 10% раствора желатины.
Суть реакции состоит в создании коллоидной среды и повышенной температуры, при которых неполные антитела адсорбируются на молекулах желатина и взаимодействуя с поверхностными антигенами эритроцитов, агглютинируют их.
Проба производится в пробирках при температуре + 46-48ºС в течение 10 - 15 мин. На дно пробирки, соответственно обозначенной, помещают 1 каплю эритроцитов донора, затем в нее добавляют 2 капли сыворотки больного и 2 капли подогретого до разжижения 10% раствора желатина. Раствор желатина перед употреблением необходимо тщательно просмотреть. При помутнении или появлении хлопьев желатина непригодна. Содержимое пробирки перемешивают путем встряхивания и помещают на водяную баню при температуре + 46-48ºС на 10 - 15 минут или в термостат при той же температуре на 30 мин. Затем в пробирку добавляют в нее 5-8 мл изотонического раствора хлорида натрия, перемешивают содержимое путем 1 - 2 кратного перевертывания пробирки и просматривают на свет невооруженным глазом или через лупу.
Наличие агглютинации в виде взвеси мелких, реже - крупных комочков на фоне просветленной или полностью обесцвеченной жидкости означает, что кровь донора несовместима с кровью больного и не может быть ему перелита.
Если содержимое пробирки остается равномерно окрашенным, слегка опалесцирует в ней не наблюдается агглютинации эритроцитов, то кровь донора совместима с кровью больного в отношении резус-фактора Rh (D).
NB ! В Инструкции 2002 г. по сравнению с предшествовавшими инструктивными документами в технику постановки пробы с 10% желатином на водяной бане внесены изменения. Ранее время пребывания на водяной бане было 10 мин., в новой Инструкции – 15 мин. Введено использование термостата вместо водяной бани.
Проба на совместимость по Rh-фактору с использованием 33% раствора полиглюкина.
Суть пробы та же, что и предыдущей, но исключен температурный фактор.
Проба проводится в пробирке без подогрева в течение 5 мин. На дно пробирки, предварительно обозначенной, вносят 2 капли сыворотки больного, 1 каплю донорской крови и 1 каплю 33% раствора полиглюкина, специально выпускаемого для этой цели во флаконах по 5 мл. Содержимое пробирки перемешивают путем встряхивания, затем пробирку наклоняют до почти горизонтального уровня и медленно поворачивают таким образом, чтобы содержимое пробирки растеклось по стенкам. Эту процедуру продолжают в течение 5 мин. Затем в пробирку доливают 3-4 мл изотонического раствора хлорида натрия, перемешивают путем 2-3 кратного плавного перевертывания пробирки, закрыв ее пробкой и просматривают на свет невооруженным глазом.
При наличии в растворе агглютинатов на фоне просветленной или полностью обесцвеченной жидкости дается заключение о том, что кровь донора несовместима с кровью больного и не может быть ему перелита. Если содержимое пробирки остается равномерно окрашенным, без признаков агглютинации, то дается заключение о совместимости крови больного и донора по Rh о (D) фактору.
Проба на совместимость перед переливанием компонентов крови. Технология выполнения. Пособие для врачей./ГОУ ДПО КГМА Росздрава. — Казань, 2011. — 35 с.
В пособии представлены технологии выполнения проб на индивидуальную совместимость перед переливанием донорских компонентов крови в целях предотвращения посттрансфузионных осложнений гемолитического типа. Приведены требования к образцам крови, к специалистам, проводящим пробы, а также порядок проведения проб в зависимости от вида переливаемой трансфузионной среды и особенности проведения проб у отдельных категорий пациентов.
Пособие содержит перечень оборудования и реагентов, необходимых для проведения проб на индивидуальную совместимость.
Предназначено для врачей всех специальностей, проводящих гемотрансфузионную терапию. Может быть использовано при подготовке специалистов в высших и средних медицинских образовательных учреждениях.
С учебным пособием можно ознакомиться в библиотеке ГОУ ДПО КГМА Росздрава по адресу 420012, г. Казань, ул. Муштари, д. 11
Введение . Целью проведения проб на индивидуальную совместимость является предотвращение трансфузий несовместимых компонентов крови. Под совместимостью понимается благоприятное сочетание крови донора и реципиента. Биологически невозможное их сочетание по антигенам и антителам различных групповых систем определяет несовместимость крови донора и реципиента.
Группа крови АВО — это набор групповых антигенов А и В и естественных анти-А, анти-В антител, который наследственно детерминирован и не меняется в течение жизни.
Система Резус — одна из наиболее полиморфных антигенных систем эритроцитов человека. Она включает около 50 серологически различных антигенов, не считая слабых, переходных и парциальных форм. На эритроцитах человека имеются 5 основных антигенов системы Резус (D, C, c, E, e). Наибольшее клиническое значение имеет антиген D. Обладая выраженными иммуногенными свойствами, антиген D в 95% является причиной гемолитической болезни новорожденного, а также причиной тяжёлых посттрансфузионных осложнений. Лиц, имеющих антиген D, относят к резус положительным (Rh+), не имеющих антиген D относят к резус отрицательным (Rh-).
В настоящее время известно более 236 антигенов эритроцитов, которые распределяются в 29 генетически независимых системах. Первостепенное клиническое значение имеют антигены систем АВО и Резус. Эритроцитарные системы Kell, MNS, Levis, Duffi, Kidd имеют меньшее практическое значение, так как они сравнительно редко вызывают сенсибилизацию. Эти системы становятся значимыми при многократных гемотрансфузиях эритроцитной массы, повторных беременностях. Антитела ко всем этим антигенам могут образоваться у человека любой группы крови системы АВО, Резус (независимо от резус-принадлежности). Они образуются при тех же условиях, что и антитела анти-D (многократные гемотрансфузии эритроцитной массы, повторные беременности) и могут служить причиной посттрансфузионных осложнений гемолитического типа и гемолитической болезни новорожденных. Если реципиенту, в крови которого имеются антитела, перелить кровь донора, эритроциты которого содержат антигены, против которых направлены антитела, такая кровь будет разрушаться в организме реципиента, т.е. она является для него несовместимой.
В настоящем пособии представлена технология выполнения проб на индивидуальную совместимость, приведены требования к образцам крови, к специалистам, проводящим пробы, а также порядок проведения проб в зависимости от вида переливаемой трансфузионной среды и особенности проведения проб у отдельных категорий пациентов.
Технология выполнения проб на совместимость перед переливанием компонентов крови:
1. Характеристика методики выполнения проб на совместимость перед переливанием компонентов крови
1.1. Требования к образцам крови
Перед процедурой забора крови на проведение проб на совместимость у реципиента уточняют его фамилию, имя и отчество. Берут сухую чистую пробирку, на которую наносят следующую информацию о пациенте: Ф.И.О., дату забора крови, для стационарных больных — номер медицинской карты. Кровь пациента забирают из вены в количестве 3-5 мл и переносят в подписанную пробирку. Для получения сыворотки пробирку с образцом крови оставляют при комнатной температуре не менее чем на 1 час или, в экстренных случаях, центрифугируют в лабораторной центрифуге при скорости 1500-2000 об/мин. в течение 5 минут. Используют образец крови реципиента, хранившийся при t+2 0 С…+8 0 С не более двух дней.
Гемолизированная кровь для исследований не используется. При наличии гемолиза процедуру взятия крови повторяют.
Предтрансфузионный образец крови реципиента хранят при температуре +2 0 С…+8 0 С в течение 5 суток. Это необходимо для дальнейшего исследования крови реципиента в специализированной лаборатории службы крови при возникновении посттрансфузионного осложнения.
В случае возникновения посттрансфузионного осложнения предтрансфузионный образец крови реципиента и остатки трансфузионной среды направляют в специализированную лабораторию службы крови для исследования.
1.2. Требования к помещению
Иммуногематологические исследования проводят в помещении с естественным освещением, температура воздуха в помещении должна быть в пределах +15 0 С …+25 0 С.
1.3. Общие требования к проведению проб на совместимость
Перед трансфузией компонентов крови проводят пробы на индивидуальную совместимость по системам АВО и Резус, и биологическую пробу.
При проведении проб на индивидуальную совместимость по системе АВО выявляется и совместимость по системе MNS, а при проведении проб на индивидуальную совместимость по системе Резус выявляется совместимость и по другим клинически значимым системам групп крови (Kell, MNS, Levis, Duffi, Kidd).
Пробы на совместимость непосредственно перед каждой трансфузией проводит врач, производящий трансфузию консервированной крови и её компонентов, после контрольного переопределения групповой принадлежности крови реципиента и донора, и контрольного переопределения резус — принадлежности крови реципиента. Экстренность трансфузии не освобождает от проведения проб на совместимость.
1.4. Требования к объемам исследований, в зависимости от вида переливаемой трансфузионной среды
1.4.1. Переливание переносчиков газов крови
Перед переливанием переносчиков газов крови проводят пробы на индивидуальную совместимость крови реципиента и донора, в том числе аутодонора, по системам АВО и Резус, а также биологическую пробу после проведения контрольных исследований групповой и резус-принадлежности крови пациента и групповой принадлежности эритроцитов донора (аутодонора).
Пробы на совместимость по группам крови АВО и Резус проводят отдельно, они не могут заменить друг друга, так как антитела разного характера требуют разных методик для своего выявления.
Пробу на индивидуальную совместимость по системе АВО проводят по одной из следующих методик: проба на совместимость на плоскости при комнатной температуре или в гелевом тесте.
Пробу на индивидуальную совместимость по системе Резус проводят по одной из следующих методик: проба с применением 33% раствора полиглюкина, проба с применением 10% раствора желатина или в гелевом тесте.
1.4.2. Переливание корректоров гемостаза и фибринолиза, средств коррекции иммунитета
Перед переливанием корректоров гемостаза и фибринолиза, средств коррекции иммунитета крови проводят биологическую пробу.
1.5. Требования к специалистам
Проведение проб на индивидуальную совместимость проводят специалисты, имеющие подготовку по вопросам иммуногематологии на специализированных циклах усовершенствования на базе учреждений дополнительного профессионального образования и (или) на базе учреждений службы крови Республики Татарстан (см. таблицу 1).
Таблица 1
Требования к специалистам для выполнения проб на совместимость перед переливанием компонентов крови
|
Медицинское учреждение |
Выполнение проб на совместимость перед переливанием компонентов крови |
Медицинский персонал |
Дополнительные требования к медицинскому персоналу |
|
Стационар, в том числе дневной стационар, в амбулаторно-поликлинических условиях |
Перед каждым переливанием крови и её компонентов |
Врач, непосредственно проводящий трансфузию |
Должны иметь специальную подготовку по вопросам иммуногематологии на специализированных циклах усовершенствования на базе учреждений дополнительного профессионального образования и (или) на базе учреждений службы крови РТ не реже одного раза в 5 лет |
2. Материальные ресурсы
Для выполнения проб на совместимость перед переливанием компонентов крови должно быть оснащено отдельное место (или специальное помещение), которое оборудуется согласно требованиям приказа МЗ РФ №2 от 09.01.1998 г. «Об утверждении инструкций по иммуносерологии».
2.1 Приборы, инструменты, изделия медицинского назначения
Таблица 2
Приборы, инструменты, изделия медицинского назначения, необходимые для выполнения проб на совместимость, а также альтернативные приборы и изделия медицинской техники.
|
Наименование прибора, изделия |
Количество приборов, |
Альтернативный прибор, изделие медицинской техники |
|
Проба на совместимость по группам крови системы АВО (на плоскости) |
||
|
Стол лабораторный |
Стол с покрытием из пластика |
|
|
Настольная лампа |
Настенная лампа |
|
|
Планшеты для иммуногематологических исследований |
1 шт. на 1 исследование |
Тарелка белого цвета фарфоровая или эмалированная |
|
Пипетка Пастера |
||
|
Стеклянные палочки (лопаточки) |
От 1 до 10 шт. |
Палочка из пластмассы |
|
Песочные часы на 5 минут |
Секундомер |
|
|
Стеклянные стаканы |
Стеклянные баночки |
|
|
Центрифуга лабораторная ОПН-3 |
Центрифуга лабораторная | |
|
с применением 33% раствора полиглюкина (в пробирке) |
||
|
Стол лабораторный |
Стол с покрытием из пластика |
|
|
Настольная лампа |
Настенная лампа |
|
|
Пробирка центрифужная |
Пробирка биологическая |
|
|
Пипетка Пастера |
Автоматическая пипетка переменного объёма (20-200 мкл) |
|
|
Песочные часы на 5 минут |
Секундомер |
|
|
Лупа с 4-6-кратным увеличением |
||
|
Штатив лабораторный на 10 гнёзд |
||
|
Стеклянные стаканы |
Стеклянные баночки |
|
|
Центрифуга лабораторная ОПН-3 |
Центрифуга лабораторная | |
|
Проба на совместимость по системе Резус с применением 10% раствора желатина (в пробирке) |
||
|
Стол лабораторный |
Стол с покрытием из пластика |
|
|
Настольная лампа |
Настенная лампа |
|
|
Баня водяная на 46-48 0 С |
Термостат на 46-48 0 С |
|
|
Пипетка Пастера |
Автоматическая пипетка переменного объёма (20-200 мкл) |
|
|
Пробирки тонкостенные (вместимостью не менее 10 мл) |
Пробирка центрифужная |
|
|
Песочные часы на 15 минут |
Секундомер |
|
|
Лупа с 4-6-кратным увеличением |
||
|
Штатив лабораторный на 10 гнёзд |
||
|
Стеклянные стаканы |
Стеклянные баночки |
|
|
Центрифуга лабораторная ОПН-3 |
Центрифуга лабораторная | |
|
Стол лабораторный |
Стол с покрытием из пластика |
|
|
Настольная лампа |
Настенная лампа |
|
|
Автоматическая пипетка переменного объёма |
5-40 мкл 1 шт.
100-1000 мкл 1 шт. |
|
|
Штатив лабораторный на 10 гнёзд |
||
|
Стеклянные стаканы |
Стеклянные баночки |
|
|
Центрифуга лабораторная ОПН-3 |
Центрифуга лабораторная | |
|
Центрифуга для гелевых карт |
||
|
Инкубатор на 37 0 С |
Термостат на 37 0 С |
|
|
Пробирка центрифужная |
Пробирка биологическая |
|
2.2. Реактивы
Для выполнения проб на индивидуальную совместимость перед трансфузией крови и её компонентов необходимы реактивы, которые представлены в таблице 3.
Таблица 3
Реагенты, необходимые для постановки проб на совместимость
|
Наименование реактива |
Документ, регламенти-рующий использование |
Количество реактива, необходимое для выполнения |
Сроки и особенности хранения реактива, работы с ним* |
|
|
Проба на совместимость по системе АВО на плоскости при комнатной температуре |
||||
|
Раствор натрия хлорида, 0,9% |
Хранится при t+15…+25 0 С. |
|||
|
Проба на совместимость с использованием 33 % раствора полиглюкина |
||||
|
Раствор полиглюкина, 33,0% |
Приказ МЗ РФ от 25.11.2002 №363 «Об утверждении Инструкции по применению компонентов крови» |
Хранится при |
||
|
Раствор натрия хлорида, 0,9% |
Хранится при |
|||
|
Проба на совместимость с использованием 10 % раствора желатина |
||||
|
Раствор желатина, 10,0% |
Приказ МЗ РФ от 25.11.2002 №363 «Об утверждении инструкции по применению компонентов крови» |
Хранится при |
||
|
Раствор натрия хлорида, 0,9% |
Хранится при |
|||
|
Проба на совместимость по системе АВО и системе Резус с использованием гелевых диагностических карт |
||||
|
Диагностические карточки Coombs+ |
Инструкции, прилагаемые к диагностическим карточкам |
От 1/4 до 1/3 шт,. в зависимости от используемой диагностической карты. |
Хранится при t+15…+25 0 С. |
|
|
Раствор для приготовления суспензии исследуемых эритроцитов |
Инструкция, прилагаемая к раствору |
От 0,5 до 1,0 мл, в зависимости от производителя |
Хранится при |
|
* — Температура внутри холодильной камеры, где хранятся реактивы, контролируется средним медработником дважды в день. Показания термометра регистрируются в «Журнале регистрации температурного режима хранения диагностических стандартов для иммуногематологических исследований» (см. приложение 1).
2.3 Прочий расходуемый материал
Для выполнения проб на совместимость перед переливанием компонентов крови используется прочий расходуемый материал (см. таблицу 4).
Таблица 4
|
Наименование |
Количество |
Примечание |
|
Ватно-марлевый тампон |
На 1 тампон: вата — 3,0 гр., бинт — 30 см. |
Для подсушивания пипетки и стеклянной палочки |
|
Медицинские перчатки одноразовые |
1 пара на каждые 3 часа работы |
Заменить немедленно при нарушении целостности или сильном загрязнении. |
|
Раствор натрия хлорида, 0,9% |
Для промывания пипеток и палочек |
|
|
Спирт этиловый медицинский, 70,0% |
3,0 гр. на 1 обработку |
Для обработки рук персона-ла после окончания работы |
|
Дезинфицирующий раствор |
В соответствии с методичес-кими указаниями по приме-нению дез. средств, разре-шённых к использованию в РФ и РТ |
Для дезинфекции биологического материала, лабораторной посуды и рабочего места. |
|
Наконечники для автомати-ческих пипеток переменного объема, одноразовые |
4 шт. на 1 исследование |
3. Порядок проведения проб на совместимость
Целью проведения проб на совместимость является предотвращение трансфузии консервированной крови и её компонентов, несовместимых с кровью реципиента. Для проб на совместимость используют сыворотку крови реципиента и образец крови донора.
Если больному переливается консервированная кровь и её компоненты из нескольких контейнеров, пробы на совместимость проводят с каждым контейнером, даже если на них обозначено, что компоненты крови получены от одного и того же донора.
3.1 Пробы на индивидуальную совместимость по системе АВО
3.1.1 Проба на совместимость по группам крови системы АВО (на плоскости)
Пробу производят на планшете со смачиваемой поверхностью.
1. Планшет маркируют, для чего указывают Ф.И.О. и группу крови реципиента, Ф.И.О. и группу крови донора и номер контейнера с кровью.
2. Из пробирки с исследуемой кровью реципиента берут осторожно пипеткой сыворотку и наносят на планшет 1 большую каплю (100 мкл).
3. Из сегмента трубки пластикового мешка с трансфузионной средой, которая приготовлена для трансфузии именно этому больному, берут маленькую каплю (10 мкл) донорских эритроцитов и наносят рядом с сывороткой реципиента (соотношение сыворотки и эритроцитов 10:1).
4. Капли перемешивают стеклянной палочкой.
5. Наблюдают за реакцией 5 минут, при постоянном покачивании планшета. По истечении этого времени добавляют 1-2 капли (50-100 мкл) раствора натрия хлорида, 0,9%.
реакция в капле может быть положительной или отрицательной.
а) положительный результат (+) выражается в агглютинации эритроцитов, агглютинаты видны невооруженным глазом в виде мелких или крупных красных агрегатов. Кровь несовместима, переливать нельзя! (см. рисунок 1).
Рисунок 1. Кровь реципиента и донора несовместима
б) при отрицательном результате (-) капля остаётся гомогенно окрашенной в красный цвет, агглютинаты в ней не обнаруживаются. Кровь донора совместима с кровью реципиента (см. рисунок 2).
Рисунок 2. Кровь донора совместима с кровью реципиента
 3.2. Пробы на индивидуальную совместимость по системе Резус
3.2. Пробы на индивидуальную совместимость по системе Резус
3.2.1. Проба на совместимость с использованием 33 % раствора полиглюкина
Порядок проведения исследования:
1. Для исследования берут пробирку (центрифужную или любую другую, вместимостью не менее 10 мл). Пробирку маркируют, для чего указывают Ф.И.О. и группу крови реципиента, и Ф.И.О донора, номер контейнера с кровью.
2. Из пробирки с исследуемой кровью реципиента осторожно берут пипеткой сыворотку и вносят 2 капли (100 мкл) на дно пробирки.
3. Из сегмента трубки пластикового мешка с трансфузионной средой, которая приготовлена для трансфузии именно этому больному, берут одну каплю (50 мкл) донорских эритроцитов вносят в эту же пробирку, добавляют 1 каплю (50 мкл) 33% раствора полиглюкина.
4. Содержимое пробирки перемешивают путём встряхивания и затем медленно поворачивают по оси, наклоняя почти до горизонтального положения так, чтобы содержимое растекалось по ее стенкам. Эту процедуру выполняют в течение пяти минут.
5. Через пять минут в пробирку добавляют по 3-5 мл физ. раствора. Содержимое пробирок перемешивают 2-3-кратным перевертыванием пробирок (не встряхивая!)
Трактовка результатов реакции:
результат учитывают, просматривая пробирки на свет невооружённым глазом или через лупу.
Если в пробирке наблюдается агглютинация в виде взвеси мелких или крупных красных комочков на фоне просветлённой или полностью обесцвеченной жидкости, значит, кровь донора не совместима с кровью реципиента. Переливать нельзя!
Если в пробирке равномерно окрашенная, слегка опалесцирующая жидкость без признаков агглютинации эритроцитов — это значит, что кровь донора совместима с кровью реципиента в отношении антигенов системы Резус и другими клинически значимыми системами (см. рисунок 3).
Рисунок 3. Результаты исследования проб на совместимость по системе Резус (с использованием 33% раствора полиглюкина и 10% раствора желатина)
 3.2.2. Проба на совместимость с использованием 10 % раствора желатина
3.2.2. Проба на совместимость с использованием 10 % раствора желатина
Раствор желатина необходимо тщательно просмотреть перед употреблением. При помутнении или появлении хлопьев, а также при потере свойств застудневания при t+4 0 С…+8 0 С желатин непригоден.
Порядок проведения исследования:
1. Для исследования берут пробирку (ёмкость не менее 10 мл). Пробирку маркируют, для чего указывают Ф.И.О., группу крови реципиента и донора, номер контейнера с кровью.
2. Из сегмента трубки пластикового мешка с трансфузионной средой, которая приготовлена для трансфузии именно этому больному, берут одну каплю (50 мкл) донорских эритроцитов, вносят в пробирку, добавляют 2 капли (100 мкл) 10% раствора желатина, прогретого на водяной бане до разжижения при температуре +46 0 С…+48 0 С. Из пробирки с кровью реципиента осторожно берут пипеткой сыворотку и вносят 2 капли (100 мкл) на дно пробирки.
3. Содержимое пробирки встряхивают для перемешивания и помещают на водяную баню (t+46 0 С…+48 0 С) на 15 минут или в термостат (t+46 0 С…+48 0 С) на 45 минут.
4. После окончания инкубации пробирку извлекают, добавляют 5-8 мл физ. раствора, содержимое пробирки перемешивают путём одно-двукратного перевёртывания и оценивают результат исследования.
Трактовка результатов реакции.
результат учитывают, просматривая пробирки на свет невооружённым глазом или через лупу, а затем просматривают путём микроскопирования. Для этого каплю содержимого пробирки помещают на предметное стекло и просматривают под малым увеличением.
Если в пробирке наблюдается агглютинация в виде взвеси мелких или крупных красных комочков на фоне просветлённой или полностью обесцвеченной жидкости — это значит, что кровь донора несовместима с кровью реципиента и не должна быть ему перелита.
Если в пробирке равномерно окрашенная, слегка опалесцирующая жидкость без признаков агглютинации эритроцитов — это значит, что кровь донора совместима с кровью реципиента в отношении антигенов системы Резус и другим клинически значимым системам (см. рисунок 3).
3.3. Проба на совместимость в гелевом тесте
При постановке в гелевом тесте пробы на совместимость проводятся сразу по системе АВО (в микропробирке Neutral) и проба на совместимость по системе Резус (в микропробирке Coombs).
Порядок проведения исследования:
1. Перед исследованием проверяют диагностические карты. Не используют карты, если в геле имеются взвешенные пузырьки, микропробирка не содержит надосадочной жидкости, наблюдается уменьшение объёма геля или его растрескивание.
2. Микропробирки подписывают (фамилия реципиента и номер донорского образца).
3. Из сегмента трубки пластикового мешка с трансфузионной средой, которая приготовлена для трансфузии именно этому больному, автоматической пипеткой берут 10 мкл донорских эритроцитов, помещают в центрифужную пробирку.
4. Добавляют 1 мл разводящего раствора.
5. Вскрывают необходимое количество микропробирок (по одной микропробирке Coombs и Neutral).
6. Автоматической пипеткой вносят по 50 мкл разведенных донорских эритроцитов в микропробирки Coombs и Neutral.
7. Добавляют в обе микропробирки по 25 мкл сыворотки реципиента.
8. Инкубируют при t+37 0 С 15 минут.
9. После инкубации карточку центрифугируют в центрифуге для гелевых карт (время и скорость задаются автоматически).
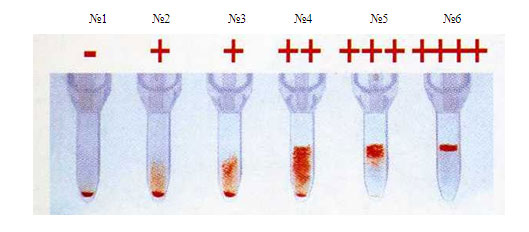
Трактовка результатов:
если осадок эритроцитов расположен на дне микропробирки, то проба считается совместимой (см. рисунок 4 №1). Если агглютинаты задерживаются на поверхности геля или в его толще, то проба несовместима (см. рисунок 4 №№2-6).
№1 №2 №3 №4 №5 №6
Рисунок 4. Результаты исследования проб на индивидуальную совместимость по системе Резус гелевой методикой
 3.4. Биологическая проба
3.4. Биологическая проба
Для проведения биологической пробы используются подготовленные к трансфузии кровь и её компоненты.
Биологическую пробу проводят независимо от объема гемотрансфузионной среды и скорости ее введения. При необходимости переливания нескольких доз крови и её компонентов биологическую пробу проводят перед началом переливания каждой новой дозы.
Техника проведения:
однократно переливают 10 мл гемотрансфузионной среды со скоростью 2-3 мл (40-60 капель) в минуту, затем переливание прекращают и в течение 3 мин наблюдают за реципиентом, контролируя у него пульс, частоту дыхания, артериальное давление, общее состояние, цвет кожи, измеряют температуру тела. Такую процедуру повторяют еще дважды. Появление в этот период даже одного из таких клинических симптомов, как озноб, боли в пояснице, чувство жара и стеснения в груди, головной боли, тошноты или рвоты, требует немедленного прекращения трансфузии и отказа от переливания данной трансфузионной среды. Образец крови направляют в специализированную лабораторию службы крови для проведения индивидуального подбора эритроцитной массы.
Экстренность трансфузии компонентов крови не освобождает от выполнения биологической пробы. Во время ее проведения возможно продолжение переливания солевых растворов.
При переливании крови и её компонентов под наркозом о реакции или начинающихся осложнениях судят по немотивированному усилению кровоточивости в операционной ране, снижению артериального давления и учащению пульса, изменению цвета мочи при катетеризации мочевого пузыря, а также по результатам пробы на выявление раннего гемолиза. В таких случаях переливание данной гемотрансфузионной среды прекращается, врач-хирург и врач анестезиолог-реаниматолог совместно с врачом-трансфузиологом обязаны выяснить причину гемодинамических нарушений. Если ничто, кроме трансфузии, не могло их вызвать, то данная гемотрансфузионная среда не переливается, вопрос дальнейшей трансфузионной терапии решается ими в зависимости от клинических и лабораторных данных.
Биологическая проба, также как и проба на индивидуальную совместимость, обязательно проводится и в тех случаях, когда переливается индивидуально подобранная в лаборатории или фенотипированная эритроцитная масса или взвесь.
После окончания переливания донорский контейнер с небольшим количеством оставшейся гемотрансфузионной среды, использованной для проведения проб на индивидуальную совместимость, подлежит обязательному сохранению в течение 48 часов при температуре +2 0 С…+8 0 С.
Реципиент после переливания соблюдает в течение двух часов постельный режим и наблюдается лечащим или дежурным врачом. Ежечасно ему измеряют температуру тела, артериальное давление, фиксируя эти показатели в медицинской карте больного. Контролируется наличие и почасовой объем мочеотделения и цвет мочи. Появление красной окраски мочи при сохранении прозрачности свидетельствует об остром гемолизе. На следующий день после переливания обязательно производят клинический анализ крови и мочи.
При амбулаторном проведении гемотрансфузии реципиент после окончания переливания должен находиться под наблюдением врача не менее трех часов. Только при отсутствии каких-либо реакций, наличии стабильных показателей артериального давления и пульса, нормальном мочеотделении пациент может быть отпущен из лечебного учреждения.
3.5. Регистрация результатов проб на совместимость
Результат контрольных исследований проб на совместимость (раздельно по каждому виду) заносят в трансфузионную карту медицинской карты больного (см. приложение 2).
3.6. Индивидуальный подбор
Индивидуальный подбор переносчиков газов крови проводится в учреждениях службы крови (СПК или ОПК) врачом клинической лабораторной диагностики, имеющим специальную подготовку по иммуногематологии на специализированных циклах и на базе учреждений службы крови РТ.
3.6.1. Показания к индивидуальному подбору
- отягощённый трансфузионный анамнез (наличие в анамнезе посттрансфузионных реакций или осложнений на предыдущие трансфузии, многократные трансфузии)
- отягощённый акушерский анамнез (наличие в анамнезе рождения детей с ГБН, мёртворождений, выкидышей на поздних сроках);
- гемолитическая болезнь новорожденных;
- затруднения при определении групповой и/или резус-принадлежности крови пациента,
- положительный или сомнительный результат хотя бы одной из проб на индивидуальную совместимость или биологической пробы;
- наличие изоиммунных антиэритроцитарных антител любой специфичности;
- многократные трансфузии.
3.6.2. Требования к образцам крови, направляемым на индивидуальный подбор
Образец крови для проведения индивидуального подбора забирают в две пробирки:
1 пробирка — с консервантом (3 мл),
2 пробирка- без консерванта (5 мл).
В качестве консерванта используют раствор ЭДТА или раствор цитрата натрия, 5% Соотношение исследуемой крови и консерванта для цитрата натрия — 10:1, для ЭДТА- 100:1.
При необходимости индивидуального подбора, новорожденному ребёнку выделяют две пробирки:
1 пробирка — с образцом крови ребёнка (не менее 1,5 мл),
2 пробирка — с образцом крови матери (5 мл).
Обе пробирки должны быть обязательно подписаны (Ф.И.О., дата забора, № истории болезни).
Направление оформляется согласно приложению № 3.
Индивидуальный подбор переносчиков газов крови является предварительной процедурой. Если эритроцитная масса или взвесь подобраны реципиенту индивидуально в специализированной лаборатории, врач, выполняющий трансфузию, перед переливанием определяет группу крови и резус-принадлежность реципиента, группу крови донора и проводит только одну пробу на совместимость на плоскости при комнатной температуре и в начале трансфузии-биологическую пробу.
3.7. Дополнительные сведения об особенностях выполнения проб на совместимость
Таблица 5
| Категорияпациентов | Индивидуальныеособенности | Характерзатруднения | Способ решенияпроблемы |
| Новорожденные | Присутствие в крови новорожденного материнских аллоантител | При положительном результате хотя бы одной из проб образец крови новорожденного и матери направляется в специализированную лабораторию для индивидуального подбора. | |
| Беременные | Наличие изоиммунных анти-эритроцитарных антител. | Несовместимость хотя бы по одной из проб | Напраляется образец крови реципиента (беременной, роженицы) в специализированную лабораторию для индивидуального подбора. |
| Больные с гематологическими или онкологическими заболеваниями, а также пациенты с другими видами патологий (ожоги, цирроз печени, сепсис и др.) | Наличие неспецифических алло- и/или аутоантител | Несовместимость хотя бы по одной из проб | Проведение индивидуальных проб на совместимость в гелевом тесте или |
| У различных категорий пациентов | Наличие анти-А 1 антител (экстра агглютинина α 1) | Несовместимость по системе АВО | Направление образца крови реципиента в специализированную лабораторию службы крови для индивидуального подбора. |
| Массивная гемотрансфузия или трансфузия несовместимых переносчиков газов крови по системе АВО и (или) системе Резус | Направление образца крови реципиента в специализированную лабораторию службы крови для индивидуального подбора. | ||
| Внутривенное введение растворов кровезаменителей. | Сомнительные результаты проб на совместимость | Направление образца крови реципиента в специализированную лабораторию службы крови для индивидуального подбора. |
Приложения
Приложение 1
|
Дата контроля |
Показания термометра |
Подпись ответственного лица |
Принятые меры |
|
|
Утро |
Вечер |
|||
Приложение 2
ТРАНСФУЗИОННАЯ КАРТА № ________
Дата трансфузии ___________________
|
Реципиент: АД____________Ps___________Т˚С_____________ Показана трансфузия _________________________ (указать наименование трансфузионной среды) Трансфузионный анамнез _____________________ _________ Акушерский анамнез _________________________ ___________________________________________ с целью ____________________________________ Результат контрольной проверки группы крови по АВО ____________ Резус __________________ |
Донор (ауто): (нужное подчеркнуть) Ф.И.О._____________________________________ Индивидуальный № __________________________ Группа крови по АВО________ Резус___________ (по данным этикетки) Результат контрольной проверки группы крови донора по АВО______________________________ |
Использованы диагностические стандарты:
1)Стандартные изогемагглютинирующие сыворотки АВО или цоликлоны (нужное подчеркнуть) следующих серий:
|
__________/____________годен до______________ |
__________/____________годен до______________ __________/____________годен до______________ |
2) Универсальный реагент антирезус Rh 0 (D) или цоликлон анти-D Супер (нужное подчеркнуть) следующих серий: ________________годен до_______________
|
Паспорт трансфузионной среды |
Результаты проб на совместимость |
Перелита трансфузионная среда |
|||||
|
Изготовитель |
Наименование |
||||||
|
Инд. подбор крови |
|||||||
|
Подготовка к переливанию |
|||||||
|
Дата заготовки |
Фильтрация |
||||||
|
Ресуспендирование |
|||||||
|
Способ и скорость трансфузии |
|||||||
|
Биол. проба |
|||||||
|
Продолжительность трансфузии |
|||||||
Наблюдение за реципиентом
|
Ранний посттрансфузионный период |
Первые сутки после трансфузии |
||||||
|
В течение трансфузии |
(для амбул. |
Общий анализ мочи от _________ |
Анализ крови от ________ |
Суточный диурез |
|||
|
Выделено |
|||||||
|
Объективно |
|||||||
|
Первая порция мочи: |
|||||||
Врач _______________________________________
Место для вклеивания Место для вклеивания результатов
этикетки трансфузионной среды индивидуального подбора крови
Согласие реципиента
на операцию переливания компонентов крови
Я, ________________________________________________________________________
получил разъяснения по поводу операции переливания крови. Мне объяснены лечащим врачом цель переливания, его необходимость, характер и особенности процедуры, ее возможные последствия, в случае развития которых я согласен на проведение всех нужных лечебных мероприятий. Я извещен о вероятном течении заболевания при отказе от операции переливания компонентов крови.
Я также получил информацию об альтернативных методах лечения.
Беседу провел врач _______________ (подпись врача). «___»__________20 г.
Пациент согласился с предложенным планом лечения, в чем расписался собственноручно
______________________________________________ (подпись пациента)
или расписался ___________________________________________ (подпись, Ф.И.О.)
В случае, когда состояние гражданина не позволяет ему выразить свою волю, а медицинское вмешательство неотложно,
Решение консилиума врачей _________________________________
__________________________________
__________________________________
или подпись лечащего (дежурного) врача с последующим уведомлением должностных лиц медицинского учреждения ______________________________________
Инструкция по заполнению трансфузионной карты
1. На каждое переливание реципиенту компонентов крови, в том числе аутокрови, аутокомпонентов заполняется трансфузионная карта и вклеивается в медицинскую карту стационарного (амбулаторного) больного в виде трансфузионной карты.
2. На оборотной стороне трансфузионной карты регистрируется в установленной форме согласие реципиента на проведение трансфузии.
3. Номер трансфузионной карты указывается в соответствии с порядковым числом трансфузии реципиенту.
4. В раздел «Реципиент» вносится результат контрольной проверки перед трансфузией группы крови реципиента по системам АВО и Резус.
5. В строке «Трансфузионный анамнез» необходимо отразить количество трансфузий и реакций на них. В строке «Акушерский анамнез» — количество беременностей, родов, абортов, наличие самопроизвольных выкидышей, мертворождений, гемолитической болезни новорожденных.
6. В раздел «Донор» вносится результат контрольного переопределения группы крови донора по системе АВО. В случае переливания корректоров гемостаза и фибринолиза, а также средств коррекции иммунитета переопределение группы крови донора по системе АВО не требуется.
7. В раздел «Паспорт трансфузионной среды» данные об изготовителе, дате заготовке переписываются с этикетки трансфузионной среды. После окончания трансфузии этикетка открепляется от контейнера с компонентом крови и вклеивается на оборотную сторону трансфузионной карты.
8. В раздел «Перелита трансфузионная среда»:
— в строке «Наименование» указывается наименование компонента крови в соответствии с этикеткой;
— в строке «Индивидуальный подбор крови» указывается лаборатория, учреждение, специалистами которого выполнен индивидуальный подбор;
— в строке «Подготовка к переливанию» указывается способ, температура и продолжительность подготовки трансфузионной среды к переливанию;
— в строке «Фильтрация» указывается тип фильтра, его изготовитель;
— строка «Ресуспендирование» заполнятся при добавлении перед трансфузией в контейнер с компонентом крови 0,9% раствора натрия хлорида изотонического с указанием его объема, № серии и изготовителя.
— в строке «Объем» указывается объем перелитой трансфузионной среды.
9. Наблюдение за реципиентом осуществляется во время трансфузии и в течение двух часов после трансфузии. При проведении трансфузии в амбулаторных условиях продолжительность наблюдения увеличивается до трех часов.
Приложение 3
Направление на СПК (ОПК)
на определение групповой и резус — принадлежности, индивидуальный подбор
(нужное подчеркнуть)
Наименование ЛПУ____________________________ отделение___________________
Ф.И.О. врача, направившего образец крови__________________________________
Контактный телефон______________________________________________________
Ф.И.О. пациента__________________________________________________________
Дата и год рождения_______________ № медицинской карты __________________
Диагноз: _________________________________________________________________
Трансфузионный анамнез (кол-во трансфузий и реакции на них) __________________
__________________________________________________________________________
__________________________________________________________________________
Акушерский анамнез (кол-во беременностей, кол-во родов, ГБН детей,
выкидыши, мертворождения, аборты) _______________________________________
_________________________________________________________________________
Результаты иммуногематологического исследования крови, полученные в ЛПУ:
Группа крови по АВО __________________________________
Резус — принадлежность ________________________________
Наличие антиэритроцитарных аллоантител________________
Наименование компонентов крови, необходимых для трансфузии___________________
____________________________________________________________________________
Дата_________________________________Подпись врача_________________________
Примечание: пробирка с образцом крови должна быть промаркирована (Ф.И.О. пациента, дата взятия крови, № медицинской карты).
Если Hb пациента ниже 70 г/л, для определения групповой и резус — принадлежности, проведения индивидуального подбора необходимо взять две пробирки:
1 пробирка с консервантом (3 мл),
2 пробирка без консерванта (5 мл).
Список сокращений
ЛПУ — лечебно-профилактическое учреждение
МЗ РТ — Министерство здравоохранения Республики Татарстан
МЗ РФ — Министерство здравоохранения Российской Федерации
ГБН — гемолитическая болезнь новорожденных
ОПК — отделение переливания крови
СПК — станция переливания крови
Пособие подготовлено зав. кафедрой анестезиологии-реаниматологии и трансфузиологии ГОУ ДПО КГМА Росздрава, профессором В.М.Белопуховым, доцентом кафедры анестезиологии-реаниматологии и трансфузиологии ГОУ ДПО КГМА Росздрава, к.м.н. Е.А.Сидоруком, ассистентами кафедры Р.С.Гадыльшиной, Л.Н.Сибгатуллиной, Э.Р.Хамидуллиной, к.м.н., С.Н. Тереховой, Т.В.Ивановой.
Рецензенты:
зав. кафедрой хирургических болезней № 1 с курсами онкологии, анестезиологии и реаниматологии ГОУ ВПО «КГМУ Росздрава», д.м.н., профессор Д.М. Красильников;
зав. кафедрой клинической анатомии и амбулаторно-поликлинической хирургии ГОУ ДПО «КГМА Росздрава», профессор В.В.Фаттахов.
Литература:
1. Донсков С.И., Мороков В.А., Дубинин И.В. Групповые антигены эритроцитов. Концепция совместимости. — М.: «ИП Скороходов», 2008. — 172 с.
2. Минеева Н.В. Группы крови человека. Основы иммуногематологии. — СПб.: ООО «А-принт», 2004. — 188 с.
3. Приказ МЗ РФ от 09.01.1998 № 2 «Об утверждении инструкций по иммуносерологии».
4. Приказ МЗ РФ от 25.11.2002 № 363 «Об утверждении Инструкции по применению компонентов крови».
5. Приказ МЗ РТ от 13.05.1999 № 367 «О мерах по предупреждению осложнений при переливании компонентов, препаратов крови, кровезаменителей».
6. Приказ МЗ РТ от 05.08.2004 №1135 «О совершенствовании работы по профилактике посттрансфузионных осложнений в учреждениях здравоохранения Республики Татарстан»
7. Приказ МЗ РТ от 27.04.2004 г. № 691 «О совершенствовании преконцепционной, пренатальной и постнатальной профилактики иммуноконфликтной беременности в Республике Татарстан».
8. Приказ МЗ РФ от 25.12.1997 г. №380 «О состоянии и мерах по совершенствованию лабораторного обеспечения диагностики и лечения пациентов в учреждениях здравоохранения Российской Федерации».
9. Приказ МЗ РТ от 16.07.2004 г. № 1047 «О порядке получения, учета и хранения компонентов крови».
10. Методические указания № 52001-109 МЗ РФ, РНИИ гематологии и трансфузиологии «Требования к проведению иммуногематологических исследований доноров и реципиентов на СПК и в ЛПУ», Санкт- Петербург, 2002 г.
12. Методическое письмо Минздравсоцразвития России от 10.10.2008 г. №15-4/3118-09 «О порядке проведения иммуногематологических исследований у беременных, рожениц, плодов и новорожденных».
13. Методические указания «Организация иммуносерологических исследований (определение группы крови и резус — фактора) больным в лабораториях лечебно-профилактических учреждений г. Самары и Самарской области».
14. Инструкция о порядке проведения иммуногематологических исследований пациентов в учреждениях здравоохранения Санкт-Петербурга, 2005 г.