خصائص نترات الفضة - استخدامها في الطب وتعليمات الاستخدام والجرعة وموانع الاستعمال. نترات الفضة: التركيب والكتلة المولية نترات الفضة مع منتج تفاعل حمض النيتريك
نترات الفضة (وتسمى أيضًا اللازورد) عبارة عن بلورات شفافة عديمة اللون أو أقلام بيضاء عديمة الرائحة. من السهل أن يذوب في الماء، ويعمل الهواء عليه كعامل مؤكسد. يتم تخزين المادة في مكان جاف مظلم في حاوية مغلقة داكنة اللون. لأول مرة، تم استخدام اللازورد لعلاج اللازورد من قبل الأطباء جون بابتيست فان هيلمونت وفرانسيس دي لا بوي سيلفيوس. حصلوا على نترات الفضة من خلال تفاعل المعدن وحمض النيتريك. وفي الوقت نفسه، اتضح أن بلورات الملح عند ملامستها للجلد تترك بقعًا داكنة، وإذا استمر التلامس لفترة كافية تبقى الحروق العميقة. اللازورد له تأثير الكيوكان معروفًا منذ فترة طويلة. تأثيره العلاجي يثبط النشاط الحيوي للميكروبات، والتركيزات الضعيفة لها تأثير قابض ومضاد للالتهابات، كما أن التركيز العالي من محلول نترات الفضة يكوي الأنسجة ويوقف النزيف. وعلى هذه الخاصية يعتمد عمل قلم اللازورد.
تطبيقات نترات الفضة
في السابق، تم استخدام محلول نترات الفضة في الطب في العديد من المجالات. بفضل تأثيره القابض والمضاد للالتهابات والمطهر، تم استخدامه في علاج قرحة المعدة والاثني عشر، كما تم استخدامه كعلاج. الوقاية من التهاب الملتحمةعند الأطفال حديثي الولادة (بعد الولادة يتم غرسها وفركها على العينين). اليوم، استخدام نترات الفضة ليس منتشرا على نطاق واسع بسبب حقيقة أن الطب الحديث اكتشف وسائل أكثر فعالية.

يستخدم محلول نترات الفضة بتركيز 0.05-0.5% خارجياً للعمليات الالتهابية للأغشية المخاطية بتركيز 4-5% - للحروق والقروح والأكزيما النازفة، لعلاج القروح والثآليل - 3-10 حل٪ أو قلم اللازورد. كما أنه يستخدم لوقف النزيف من الأوعية الصغيرة. داخليا، تستخدم نترات الفضة حصرا في المحاليل الضعيفة كمطهر وقابض لقرحة المعدة والإسهال.
تناول الدواء عن طريق الفم على المدى الطويل يسبب ما يسمى argyria، عندما يأخذ الجلد وأسرة الظفر والقزحية والأغشية المخاطية وأنسجة الأعضاء الداخلية لونًا رماديًا أسود أو بنيًا بسبب ترسب الفضة المخفضة فيها.
من الضروري أيضًا أن تضع في اعتبارك أن اللازورد غير متوافق:
- مع المواد العضوية (وهي عرضة للتحلل)،
- مع الهاليدات القابلة للذوبان في الماء (البروميدات، اليودات، الكلوريدات)،
- مع عوامل الاختزال (نوفوكائين، الأدرينالين، التخدير، الريسورسينول)،
- مع المستخلصات النباتية (بسبب التحلل واكتساب الخليط لونًا بنيًا).
فعالية اللازورد
وفقًا للدراسات، عند علاج الثآليل ثلاث مرات في الشهر بفاصل عشرة أيام، اختفت تمامًا في 43٪ من الحالات (أظهرت المجموعة الضابطة، التي استخدمت دواءً وهميًا، 11٪)، وانخفضت بنسبة 26٪ (مقارنة بـ 14 حالة). % في المجموعة الضابطة). هكذا، هذه الطريقة ليست فعالة. لا ينبغي بأي حال من الأحوال معالجة الثآليل الموجودة على الوجه باستخدام قلم اللازورد، حيث يوجد خطر كبير للتندب والحروق.
نترات الفضة: التاريخ والخصائص والتطبيقات
مرادفات: نترات الفضة، اللازورد، ملح النيتروجين والفضة، حجر الجحيم
الاسم اللاتيني: أرجنتي نيتراس
لقد عرف معدن الفضة الثمين ومشتقاته العديدة منذ زمن سحيق. ربما تكون نترات الفضة واحدة من أملاح هذا المعدن الأكثر شيوعًا والأكثر استخدامًا.
في البداية، كانت هذه المادة بمثابة مطهر، وكانت تستخدم لكي الجروح أو لوقف النزيف. تم علاج الصرع والتهاب المعدة وقرحة المعدة بمستحضرات نترات الفضة. مع مرور الوقت، وجد اللازورد استخدامًا اقتصاديًا آخر: فقد تم استخدامه لرسم الأيقونات وصنع مستحضرات التجميل. منذ نهاية القرن التاسع عشر، بدأ استخدام نترات الفضة في صناعة الأفلام والمواد الفوتوغرافية.
إيصال
يتم الحصول على نترات الفضة عن طريق تفاعل الفضة مع حمض النيتريك المركز بثقل نوعي يتراوح بين 1.18-1.20. تتم تنقية المادة الناتجة من الشوائب.
في عام 2012، أتقن المتخصصون من شركة LenReativ JSC إنتاج أملاح المعادن الثمينة، بما في ذلك نترات الفضة. تتيح لنا الجودة العالية لجميع عمليات تصنيع وتنقية المنتج الناتج إنتاج نترات الفضة من الدرجة "النقية كيميائيًا".
يمكنكم معرفة المزيد عن نترات الفضة التي تنتجها شركتنا وتكلفتها وشروط الشراء عبر الاتصال..
المظهر والخصائص
بلورات شفافة عديمة اللون على شكل ألواح أو قضبان بلورية بيضاء اللون، عديمة الرائحة.
شديد الذوبان في الماء (1:0.6) والإيثانول (1:30). نترات الفضة غير قابلة للذوبان في حمض النيتريك المركز.
غير متوافق مع المواد العضوية (تتحلل)، مع الكلوريدات والبروميدات واليوديدات (شكل رواسب). يصبح داكنًا عند تعرضه للضوء.

تتحلل البلورات عند درجات حرارة أعلى من 350 درجة مئوية، وتنتج الفضة المعدنية.
مثل كل أملاح الفضة، نترات الفضة سامة. يجب أن يتم تخزينه في حاويات خاصة بأغطية وفي مكان محمي من الضوء.
من حيث المعايير الفيزيائية والكيميائية، يجب أن تتوافق نترات الفضة مع المتطلبات والمعايير المحددة في GOST 1277-75.
| اسم المؤشر | التردد العالي | ChDA | ح |
| جزء كبير من AgNO 3،٪، وليس أقل | 99,9 | 99,8 | 99,7 |
| جزء كبير من المواد غير القابلة للذوبان في الماء،٪، لا أكثر | 0,003 | 0,004 | 0,01 |
| جزء كبير من الكلوريدات (Cl)،٪، لا أكثر | 0,0002 | 0,0005 | 0,001 |
| جزء كبير من الكبريتات، (SO 4)٪، لا أكثر | 0,002 | 0,002 | 0,002 |
| جزء كتلة من الحديد (Fe)،٪، لا أكثر | 0,0002 | 0,0003 | 0,0005 |
| جزء كتلة من البزموت (ثنائي)٪، لا أكثر | 0,0005 | 0,001 | 0,005 |
| جزء كبير من النحاس (Cu)،٪، لا أكثر | 0,0005 | 0,002 | 0,003 |
| جزء كبير من الرصاص (Pb)٪، لا أكثر | 0,0005 | 0,0005 | 0,001 |
| حمض النيتريك الحر | يجب اجتياز الاختبارات وفقًا للفقرة 3.9 | يجب اجتياز الاختبارات وفقًا للفقرة 3.9 | |
| الجزء الكتلي من المواد التي لم يترسبها حمض الهيدروكلوريك،٪، لا أكثر | 0,01 | 0,04 | 0,06 |
طلب
تستخدم نترات الفضة على نطاق واسع في إنتاج المرايا ومواد التصوير الفوتوغرافي، وفي الطب، والبصريات، وإنتاج طلاءات الفضة، وتلوين بعض المواد العضوية، وإنتاج المستحضرات المختلفة التي تحتوي على الفضة، وإنتاج الفضة المعدنية نفسها. . تستخدم نترات الفضة أيضًا ككاشف لحمض الهيدروكلوريك في المختبرات.
تستخدم نترات الفضة كمحفز في الصناعة الكيميائية وفي المختبرات.
تعتبر محاليل نترات الفضة ضرورية لإنتاج البطاريات عالية الطاقة.
يعد ملح المعادن الثمينة ضروريًا عند إنشاء اللون الأصفر الذهبي على أكواب الرصاص عالية الجودة. يظهر اللون أثناء عملية تكنولوجية معقدة.
أولئك الذين يحبون جمع العملات البرونزية أو النحاسية القديمة يعرفون أن العملات المعدنية تكتسب على مر السنين طبقة خاصة تسمى "مرض الكلور". يمكن القضاء على هذه المشكلة بمساعدة نترات الفضة، والتي يمكن أن تدمر "الخضر" وتخلق طبقة واقية على العملة.
محتوى
تستخدم المادة الفعالة نترات الفضة في الطب بسبب خصائصها المطهرة. الاسم اللاتيني هو Argentum nitricum أو Lapis infernalis، والثاني يُترجم على أنه "اللازورد الجهنمي". سميت نترات الفضة بهذا الاسم بسبب كاويتها القوية. يتم التأثير العلاجي عن طريق المحاليل المخففة المستخدمة في طب الأسنان وطب العيون ومجالات الطب الأخرى، إلى جانب الأدوية المضادة للبكتيريا الأخرى.
ما هي نترات الفضة
مزيج ملح الفضة مع حمض النيتريك يشكل تكوين بلورات على شكل الماس عديمة اللون والطعم والرائحة، ما يسمى بأقلام اللازورد. تذوب المادة في الماء والكحول وتغمق في ضوء الشمس المباشر. عرف هيلستون في الطب منذ القدم بأنه مطهر. النترات لها تأثير قابض، ويتم كي الجروح والقروح والثآليل بالمحلول. يعتمد التأثير في الكيمياء العضوية على حقيقة أن أيونات الفضة تعطل عملية التمثيل الغذائي للميكروبات المسببة للأمراض.
ملكيات
إن استخدام دواء يعتمد على نترات المعدن له ما يبرره من خلال تأثيره المضاد للالتهابات. تربط الأملاح المعدنية مجموعات السلفهيدريل والكربوكسيل من الأحماض الأمينية، مما يسبب تمسخ البروتين. وبسبب هذه الخاصية، يتم استخدامه في صناعة الأدوية، ويتم تطبيقه خارجيًا أو داخليًا حسب التركيز. لا يمكنك استخدام النترات النقية: فهي مادة كاوية للغاية ويمكن أن تسبب حروقًا كيميائية.
معادلة
الصيغة البنائية للمادة النقية هي AgNO3. للأغراض الطبية ، تستخدم المحاليل والمراهم المائية والكحولية في الأدوية. طرق الاستخدام تعتمد على الغرض. يتراوح محلول نترات الفضة من 0.05% إلى 10%. يتم تحديد الجرعة من قبل الطبيب، ومن الضروري استشارة الطبيب قبل الاستخدام. في بعض الأحيان يتم وصف الدواء عن طريق الفم: الأيونات المعدنية لها تأثير قابض، وتوقف الإسهال من أصل جرثومي.
نترات الفضة في الطب
وكقاعدة عامة، يتم استخدام الحلول والمراهم على أساس اللازورد خارجيا. نظرًا لخاصية تدمير مركبات البروتين ووقف استقلاب البكتيريا المسببة للأمراض، تظل المادة واحدة من أكثر المطهرات فعالية ولها تأثير مضاد للالتهابات بشكل واضح. يجوز استخدام محلول ضعيف على الأغشية المخاطية والجلد. الآثار المفيدة لللازورد:
- للقروح والتقرحات، لها تأثير الظهارة.
- يساعد على شفاء الشقوق.
- في التهاب الملتحمة الحاد، يخفف الالتهاب.
- في حالة الحروق، قضمة الصقيع، يزيل الأنسجة الميتة.
- يكوي الثآليل والأورام الحميدة.
- يوقف الإسهال، وله تأثير قابض.
للاستخدام الداخلي، يتم وصف أقراص على أساس الطين الأبيض، مما يساعد على تحييد الكاوية الزائدة للمادة. يتم استخدام الأدوية التي تعتمد على هذه المادة لعلاج التهاب المعدة وقرحة المعدة والاثني عشر، وقد ثبت فعالية اللازورد ضد بكتيريا هيليكوباكتر بيلوري، وهي السبب الرئيسي للأمراض الالتهابية في الجهاز الهضمي.
تعليمات لاستخدام نترات الفضة
عند استخدامه خارجيًا، يكون اللازورد له تأثير ظهاري ومضاد للالتهابات وله خصائص مبيد للجراثيم. يجب أن يكون الحل لهذا التطبيق ضعيفا من 0.1% إلى 0.5%. في هذا الشكل تعالج المادة الشقوق والتهاب الملتحمة وأمراض الحلق - التهاب الحنجرة والتهاب البلعوم والآفات الجلدية القيحية. ويمكن وصف مرهم يحتوي على نترات الفضة لكي الثآليل وإزالة الأورام، ثم يصل تركيز المادة إلى 30%.

مؤشرات للاستخدام
يتم تحديد طرق استخدام الدواء حسب الغرض وتوطين المرض. المؤشرات الرئيسية التي تستخدم المادة على نطاق واسع هي أمراض الأسنان - التهاب الفم، وتقرحات الأغشية المخاطية. تستخدم التركيبات التي لها خصائص الكي في التجميل. توصف المستحضرات الفموية المعتمدة على هذه المادة لعلاج قرحة المعدة وقرحة الاثني عشر والتهاب المعدة التآكلي. النطاق الواسع لاستخدامات اللازورد يتضمن العديد من المؤشرات، وفي كل حالة يجب على المرضى استشارة الطبيب.
آثار جانبية
Hellstone ليس علاجًا ضارًا. اللازورد الفضي في شكله المركز يمكن أن يسبب حروقًا شديدة، لذلك لا ينصح بعمل الحلول بنفسك. أحد الآثار الجانبية الشائعة للاستخدام على المدى الطويل، وخاصة الداخلي، هو التصبغ، وهي حالة خاصة تنتج عن رد فعل الجسم تجاه المعادن الزائدة. يتميز بتغير في لون الجلد: تصبح البشرة ذات صبغة مزرقة مميزة، ويفقد الشعر صبغته الطبيعية. لتجنب الإصابة بمرض الأرجيريا، اتبع بدقة الجرعة التي وصفها لك الطبيب.
موانع
إن المستحضرات المعتمدة على اللازورد الفضي يتحملها جسم الإنسان بشكل جيد. في حالات نادرة، قد تحدث تفاعلات حساسية، على الرغم من أن عدم تحمل أيونات المعادن أو المكونات الأخرى نادر جدًا. في حالة حدوث آثار جانبية غير مرغوب فيها، يجب التوقف فورًا عن استخدام المحلول أو الأقراص أو المراهم. في حالة الاستخدام الخارجي، يجب شطف الجلد أو الغشاء المخاطي بالماء النظيف. يتضمن وصف الدواء التركيز والنوعية وخصائص دواء معين، ولا ينتهك شروط الاستخدام.

سعر نترات الفضة
تتوفر الأدوية التي تعتمد على نترات الفضة في مجموعة واسعة من الصيدليات. يتم بيعها على شكل مركزات أو أدوية جاهزة للاستخدام. تعتمد التكلفة على العلامة التجارية والجرعة ومنطقة الاستخدام. تذكر أن خصائص الأدوية تعتمد على التركيب والتركيز، لذلك، على الرغم من أن الأدوية تباع بدون وصفة طبية، تأكد من استشارة طبيبك فيما يتعلق باختيار دواء معين.
|
اسم |
محول الطول والمسافة محول الكتلة محول قياسات حجم المنتجات السائبة والمنتجات الغذائية محول المساحة محول الحجم ووحدات القياس في وصفات الطهي محول درجة الحرارة محول الضغط والإجهاد الميكانيكي ومعامل يونغ محول الطاقة والعمل محول الطاقة محول القوة محول الزمن محول السرعة الخطي محول الزاوية المسطحة الكفاءة الحرارية وكفاءة استهلاك الوقود محول الأرقام في أنظمة الأعداد المختلفة محول وحدات قياس كمية المعلومات أسعار العملات الملابس النسائية ومقاسات الأحذية الملابس الرجالية ومقاسات الأحذية السرعة الزاوية وتحويل تردد الدوران محول التسارع محول التسارع الزاوي محول الكثافة محول الحجم المحدد محول عزم القصور الذاتي محول عزم القوة محول عزم الدوران محول الحرارة النوعية للاحتراق (بالكتلة) كثافة الطاقة والحرارة النوعية للاحتراق المحول (بالحجم) محول فرق درجة الحرارة معامل محول التمدد الحراري محول المقاومة الحرارية محول التوصيل الحراري محول السعة الحرارية المحددة محول التعرض للطاقة والإشعاع الحراري محول طاقة التدفق الحراري محول معامل نقل الحرارة محول معدل التدفق الحجمي محول معدل التدفق الشامل محول معدل التدفق المولي محول كثافة التدفق الشامل محول التركيز المولي تركيز الكتلة في المحلول محول ديناميكي (مطلق) محول اللزوجة محول اللزوجة الحركية محول التوتر السطحي محول نفاذية البخار محول كثافة تدفق بخار الماء محول مستوى الصوت محول حساسية الميكروفون محول مستوى ضغط الصوت (SPL) محول مستوى ضغط الصوت مع مرجع محدد محول النصوع الضغط محول شدة الإضاءة محول الإضاءة رسومات الكمبيوتر محول الدقة التردد و محول الطول الموجي قوة الديوبتر والطول البؤري قوة الديوبتر وتكبير العدسة (×) محول الشحنة الكهربائية محول كثافة الشحنة الخطية محول كثافة الشحنة السطحية محول كثافة الشحنة الحجمية محول التيار الكهربائي محول كثافة التيار الخطي محول كثافة التيار السطحي محول قوة المجال الكهربائي محول الجهد الكهروستاتيكي محول المقاومة الكهربائية محول المقاومة الكهربائية محول الموصلية الكهربائية محول الموصلية الكهربائية السعة الكهربائية محول الحث محول قياس الأسلاك الأمريكية المستويات في ديسيبل (ديسيبل مللي أمبير أو ديسيبل) ، ديسيبل (ديسيبل) ، واط ، إلخ. الوحدات محول القوة المغناطيسية محول قوة المجال المغناطيسي محول التدفق المغناطيسي محول الحث المغناطيسي الإشعاع. الإشعاع المؤين الممتص محول معدل الجرعة النشاط الإشعاعي. محول الاضمحلال الإشعاعي Radiation. محول جرعة التعرض للإشعاع. محول الجرعة الممتصة محول البادئة العشرية نقل البيانات محول وحدة الطباعة ومعالجة الصور محول وحدة حجم الأخشاب حساب الكتلة المولية جدول D. I. Mendeleev الدوري للعناصر الكيميائية
صيغة كيميائية
الكتلة المولية لـ AgNO3، نترات الفضة 169.8731 جم / مول
107.8682+14.0067+15.9994 3
الكسور الكتلية للعناصر الموجودة في المركب
استخدام حاسبة الكتلة المولية
- يجب إدخال الصيغ الكيميائية حسب حالة الأحرف
- يتم إدخال المشتركين كأرقام عادية
- يتم استبدال النقطة الموجودة على الخط الأوسط (علامة الضرب)، المستخدمة، على سبيل المثال، في صيغ الهيدرات البلورية، بنقطة عادية.
- مثال: بدلاً من CuSO₄·5H₂O في المحول، لسهولة الإدخال، يتم استخدام التهجئة CuSO4.5H2O.
حاسبة الكتلة المولية
خلد
تتكون جميع المواد من ذرات وجزيئات. في الكيمياء، من المهم قياس كتلة المواد التي تتفاعل وتنتج عنها بدقة. بحكم التعريف، المول هو وحدة SI لكمية المادة. يحتوي المول الواحد بالضبط على 6.02214076×10²³ من الجسيمات الأولية. هذه القيمة تساوي عدديًا ثابت أفوجادرو N A عند التعبير عنه بوحدات mol⁻¹ ويسمى رقم أفوجادرو. كمية المادة (الرمز ن) للنظام هو مقياس لعدد العناصر الهيكلية. يمكن أن يكون العنصر الهيكلي ذرة أو جزيء أو أيون أو إلكترون أو أي جسيم أو مجموعة من الجزيئات.
ثابت أفوجادرو N A = 6.02214076×10²³ mol⁻¹. رقم أفوجادرو هو 6.02214076×10²³.
بمعنى آخر، المول هو كمية من المادة تساوي في كتلتها مجموع الكتل الذرية لذرات وجزيئات المادة مضروبة في رقم أفوجادرو. وحدة كمية المادة، المول، هي إحدى وحدات النظام الدولي السبعة الأساسية ويرمز لها بالمول. وبما أن اسم الوحدة ورمزها واحد، تجدر الإشارة إلى أن الرمز لا يتم رفضه، على عكس اسم الوحدة الذي يمكن رفضه حسب القواعد المعتادة للغة الروسية. المول الواحد من الكربون 12 النقي يساوي 12 جم بالضبط.
الكتلة المولية
الكتلة المولية هي خاصية فيزيائية للمادة، تُعرّف بأنها نسبة كتلة هذه المادة إلى كمية المادة بالمول. وبعبارة أخرى، هذه هي كتلة مول واحد من المادة. وحدة SI للكتلة المولية هي كيلوغرام/مول (كجم/مول). ومع ذلك، اعتاد الكيميائيون على استخدام الوحدة الأكثر ملائمة g/mol.
الكتلة المولية = جم/مول

الكتلة المولية للعناصر والمركبات
المركبات هي مواد تتكون من ذرات مختلفة مرتبطة ببعضها البعض كيميائيا. على سبيل المثال، المواد التالية التي يمكن أن تتواجد في مطبخ أي ربة منزل هي مركبات كيميائية:
- الملح (كلوريد الصوديوم) NaCl
- السكر (السكروز) C₁₂H₂₂O₁₁
- الخل (محلول حمض الأسيتيك) CH₃COOH
الكتلة المولية للعنصر الكيميائي بالجرام لكل مول هي نفس كتلة ذرات العنصر معبرًا عنها بوحدات الكتلة الذرية (أو الدالتون). الكتلة المولية للمركبات تساوي مجموع الكتل المولية للعناصر المكونة للمركب، مع مراعاة عدد الذرات الموجودة في المركب. على سبيل المثال، الكتلة المولية للماء (H₂O) تبلغ تقريبًا 1 × 2 + 16 = 18 جم/مول.
الكتلة الجزيئية

الكتلة الجزيئية (الاسم القديم هو الوزن الجزيئي) هي كتلة الجزيء، ويتم حسابها على أنها مجموع كتل كل ذرة تشكل الجزيء، مضروبة في عدد الذرات الموجودة في هذا الجزيء. الوزن الجزيئي هو بلا أبعادكمية فيزيائية تساوي عدديا الكتلة المولية. أي أن الكتلة الجزيئية تختلف عن الكتلة المولية في البعد. على الرغم من أن الكتلة الجزيئية ليس لها أبعاد، إلا أنها لا تزال لها قيمة تسمى وحدة الكتلة الذرية (amu) أو دالتون (Da)، والتي تساوي تقريبًا كتلة بروتون أو نيوترون واحد. وحدة الكتلة الذرية تساوي أيضًا عدديًا 1 جم / مول.
حساب الكتلة المولية
يتم حساب الكتلة المولية على النحو التالي:
- تحديد الكتل الذرية للعناصر وفقا للجدول الدوري.
- تحديد عدد ذرات كل عنصر في الصيغة المركبة؛
- تحديد الكتلة المولية عن طريق جمع الكتل الذرية للعناصر الموجودة في المركب مضروبة في عددها.
على سبيل المثال، دعونا نحسب الكتلة المولية لحمض الأسيتيك
إنها تتكون من:
- اثنين من ذرات الكربون
- أربع ذرات هيدروجين
- ذرتين من الأكسجين
- الكربون C = 2 × 12.0107 جم/مول = 24.0214 جم/مول
- هيدروجين H = 4 × 1.00794 جم/مول = 4.03176 جم/مول
- الأكسجين O = 2 × 15.9994 جم / مول = 31.9988 جم / مول
- الكتلة المولية = 24.0214 + 4.03176 + 31.9988 = 60.05196 جم/مول
تقوم الآلة الحاسبة لدينا بإجراء هذه العملية الحسابية بالضبط. يمكنك إدخال صيغة حمض الأسيتيك فيه والتحقق مما يحدث.
هل تجد صعوبة في ترجمة وحدات القياس من لغة إلى أخرى؟ الزملاء على استعداد لمساعدتك. انشر سؤالاً في TCTermsوفي غضون دقائق قليلة سوف تتلقى إجابة.
يتم نشر نص العمل بدون صور وصيغ.
النسخة الكاملة من العمل متاحة في علامة التبويب "ملفات العمل" بتنسيق PDF
حاليا، في المدارس الحديثة (خاصة في المناطق الريفية والريفية) هناك مشكلة في طلب الكواشف الكيميائية وتسليمها. واحدة من أغلى المواد المستخدمة في ورش الكيمياء المدرسية هي نترات الفضة (I). تتراوح تكلفتها لكل 1 جرام من 25 إلى 45 روبل. يختلف السعر حسب الشركة المصنعة والمسافة بين الشركة المصنعة والعملاء.
تُستخدم نترات الفضة (I) في العمل الكيميائي المدرسي لإجراء تفاعلات نوعية مشرقة في الكيمياء العضوية وغير العضوية. ولذلك فإن غيابه في المختبر المدرسي يعد عيبًا كبيرًا في "الرؤية الكيميائية".
وهكذا، كان الهدف من العمل هو الحصول على نترات الفضة (I) في مختبر المدرسة.
من أين يمكنك الحصول على معدن ثمين مثل الفضة؟! ومن المعروف أن الفضة موجودة في الأشعة السينية والأفلام المطورة والصور الفوتوغرافية. ومنهم تم الحصول على نترات الفضة (I) على عدة مراحل.
أهداف البحث:
1. باستخدام المصادر الأدبية، تحديد المواد الخام الثانوية لإنتاج نترات الفضة
2. الحصول على نترات الفضة من أشياء مختلفة
3. قارن محصول منتجات التفاعل
4. إجراء التفاعلات النوعية مع نترات الفضة (I) التي تم الحصول عليها في مختبر المدرسة.
الفصل الأول. مراجعة الأدبيات
1. 1 الفضة وخصائصها
أصبحت الفضة معروفة في وقت لاحق بكثير عن الذهب، على الرغم من أنها موجودة أيضًا في حالتها الأصلية. وفي مصر عثر علماء الآثار على مجوهرات فضية تعود إلى عصر ما قبل الأسرات (5000 - 3400 قبل الميلاد). ومع ذلك، لفترة طويلة، كانت الفضة نادرة جدًا وكانت قيمتها أعلى من الذهب.
الفضة النقية لا تغمق في الهواء، ولكن الفضة مع الشوائب يمكن أن تصبح داكنة بسرعة كبيرة (الشكل 1).
أرز. 1. قطعة فضية من محل مجوهرات (أ) وبعد ارتدائها لفترة من قبل الشخص (ب).
يشير التغميق إلى وجود الكبريت في الهواء، على سبيل المثال، بسبب تلوث الهواء أو مرض صاحب السلعة الفضية. بعد الذهب، تعد الفضة أسهل المعادن في المعالجة. من 30 جرامًا من الفضة يمكنك رسم سلك يزيد طوله عن 50 كيلومترًا. وهو أيضًا أفضل موصل معروف للحرارة والكهرباء.
مركبات الفضة غالبا ما تكون غير مقاومة للحرارة والضوء. أدى اكتشاف الحساسية الضوئية لأملاح الفضة إلى ظهور التصوير الفوتوغرافي والزيادة السريعة في الطلب على الفضة. في منتصف القرن العشرين، تم استخدام ما يقرب من نصف الفضة المستخرجة في صناعة الأفلام والمواد الفوتوغرافية. أحد مركبات الفضة هو اللازورد.
1.2 استخدام نترات الفضة في الطب
نترات الفضة، اللازورد (AgNO 3) هو مسحوق عديم اللون (أبيض)، قابل للذوبان بدرجة عالية في الماء في الضوء ويتحول إلى اللون الأسود مع إطلاق الفضة المعدنية (الشكل 2).
أرز. 2. ظهور نترات الفضة
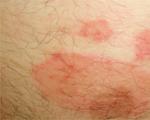
تم استخدام اللازورد لأول مرة في القرن السابع عشر من قبل الأطباء الكيميائيين: الهولندي جان بابتيست فان هيلمونت والألماني فرانسيس دي لا بوي سيلفيوس. لقد تعلموا إنتاج نترات الفضة عن طريق تفاعل المعدن مع حمض النيتريك. لقد اكتشف العلماء أن ملامسة بلورات ملح الفضة الناتج يؤدي إلى ظهور بقع سوداء على الجلد، ومع التلامس لفترة طويلة يحدث حروق عميقة (الشكل 3). ولذلك أطلق على هذه المادة اسم "حجر الجحيم".
أرز. 3. ظهور بقع سوداء عند ملامسة نترات الفضة.
حجر الهيل ليس نترات الفضة النقية، ولكنه خليط من نترات البوتاسيوم، ويتم صبه أحيانًا على شكل أعواد قلم اللازورد. التأثير العلاجي لنترات الفضة هو قمع النشاط الحيوي للكائنات الحية الدقيقة. بتركيزات صغيرة يعمل كمضاد للالتهابات وقابض.
العمل الدوائي - مطهر، قابض، مضاد للالتهابات، الكي، مضاد للميكروبات، مبيد للجراثيم. يربط مجموعات السلفهيدريل والكربوكسيل، والتي يمكن أن تسبب تغييرًا في تكوين البروتين أو بنيته أو تسبب تمسخه. عندما تنفصل نترات الفضة، تسبب أيونات الفضة ترسيب البروتينات وتسبب تأثيرًا مبيدًا للجراثيم. يكتسب ألبومينات الفضة، الذي يتكون من تفاعل نترات الفضة مع بروتينات الأنسجة، لونًا أسود تدريجيًا (وهذا بسبب اختزال الفضة المعدنية من الألبومينات)، مما يؤدي بدوره إلى التفاعل مع مجموعات نشطة من الإنزيمات. يمنع بعض أنظمة الإنزيمات، وبالتالي يعطل عمليات التمثيل الغذائي في الخلية الميكروبية. في هذا الصدد، نترات الفضة، بعد تأثير مبيد للجراثيم على المدى القصير، لها تأثير جراثيم على المدى الطويل. نترات الفضة بتخفيف 1: 1000 تقضي على معظم الكائنات الحية الدقيقة.
في السابق، تم استخدام نترات الفضة لعلاج التهاب المعدة المزمن والقرحة الهضمية للمعدة والاثني عشر (عن طريق الفم، في شكل محلول 0.05٪). يمكن استخدام محلول (2٪) للوقاية من عدوى المكورات البنية في العين عند الأطفال حديثي الولادة.
1.3 المواد الخام الثانوية المحتوية على الفضة
الموردون الرئيسيون للمواد الخام المحتوية على الفضة هم الصناعات الكيميائية والإذاعية والكهربائية. الإنتاج: المجوهرات والساعات والمرايا، بالإضافة إلى غرف الأشعة في العيادات الطبية.
تأتي نفايات الصناعة الكيميائية على شكل كتل ملامسة مستهلكة (20-80% Ag)؛ المحفزات المستهلكة (أكثر من 80% Ag)؛ الحمأة (60 إلى 80% Ag)؛ خردة معدات الفضة (20-25% Ag).
يحدث تكوين النفايات المحتوية على الفضة في صناعة المرايا أثناء عملية طلاء المرايا بالفضة وزينة شجرة عيد الميلاد وما إلى ذلك.
يرسل إنتاج الساعات لمعالجة الأنواع التالية من المواد الخام التي تحتوي على Ag،٪: جنود الفضة - من 15 إلى 99؛ اتصالات الفضة 20-80؛ نشارة الخشب والنشارة - من 10 إلى 70.
يتم الحصول على ما يلي من المؤسسات الطبية لاستخراج الفضة،٪: رماد أفلام الأشعة السينية والمطبوعات الفوتوغرافية - من 0.5 إلى 50؛ كبريتيد الفضة 45-65.
تتم معالجة كمية كبيرة من المواد الخام المحتوية على الفضة (ما يصل إلى 30-40٪ Ag) على شكل نفايات من الصناعات الإلكترونية والكهربائية: بطاريات الفضة والزنك والكادميوم الفضية الفاشلة (من 30 إلى 60٪)؛ سبائك الاتصال، وجنود الفضة (من 5 إلى 99٪)؛ تركيبات معدنية سيراميكية 25-50.
بالإضافة إلى النفايات المدرجة، يتم الحصول على أنواع أخرى من المواد الخام للمعالجة، والتي تختلف بشكل حاد في الخصائص الكيميائية والفيزيائية.
الباب الثاني. كائنات وطرق البحث
2.1 كائنات البحث
تم استخدام الأشعة السينية، والأفلام الفوتوغرافية، ولعبة شجرة عيد الميلاد، ومرآة كأشياء للدراسة للحصول على كاشف نترات الفضة (الشكل 4).
أرز. 4. المواد الخام الثانوية المحتوية على الفضة:
أ- الأشعة السينية. ب- فيلم فوتوغرافي.
2.2 طريقة الحصول على نترات الفضة من الأشعة السينية والأفلام الفوتوغرافية
تم تقطيع الأشعة السينية والأفلام الفوتوغرافية إلى قطع صغيرة وتم قياس 17 جرامًا منها على ميزان. بعد ذلك، تم إذابة المادة المحضرة في حمض النيتريك (المركز) (الشكل 5).
أرز. 5. إذابة الأشعة السينية في حامض النيتريك.
بعد إذابة الأشياء، تمت إضافة محلول ملح الطعام. تم غسل المادة المترسبة الناتجة بالماء وملئها بمحلول حمض الهيدروكلوريك. بعد ذلك تم وضع حبيبات الزنك في الرواسب لإجراء تفاعل الاستبدال. عند الانتهاء من التفاعل، تم غسل المسحوق الناتج وتجفيفه. تم إذابة الفضة المجففة في محلول حمض النيتريك، ثم تبخرت وحلت في الماء المقطر.
2.3 طريقة الحصول على نترات الفضة من المنتجات المحتوية على الفضة
تم تنظيف لعبة ومرآة شجرة عيد الميلاد من أنواع مختلفة من الملوثات وملئها بمحلول حمض النيتريك حتى يذوب (الشكل 6). تم تبخير المحلول الناتج والحصول على مسحوق تم تحميصه في كوب من الخزف. تمت إضافة الماء إلى المنصهر المبرد، ثم تم سكب محلول نترات الفضة الناتج.
أرز. 6. إذابة زينة شجرة عيد الميلاد في محلول حمض النيتريك.
2.4 منهجية إجراء التفاعلات النوعية لأيونات الهاليد
تمت إضافة محلول نترات الفضة الناتجة إلى محاليل الأملاح التي تحتوي على أيونات الكلوريد، وأيونات البروميد، وأيونات اليوديد. ولوحظ هطول الأمطار.
2.5 منهجية تفاعل "المرآة الفضية".
تمت إضافة نفس الكمية تقريبًا من الجلوكوز إلى محلول نترات فضة الأمونيوم وتم تسخين محتويات أنبوب الاختبار حتى تتشكل مادة راسب على الجدران.
الفصل الثالث. النتائج ومناقشتها
3.1 نتائج الحصول على نترات الفضة من الأشعة السينية والأفلام الفوتوغرافية
بعد إضافة حمض النيتريك المركز، تم إطلاق أيونات الفضة في المحلول. ثم، عند إضافة كلوريد الصوديوم إلى المحلول الناتج، يتكون راسب أبيض (1) (الشكل 7):
Ag + + NaCl → AgCl↓ + Na + (1).
أرز. 7. تكوين راسب أبيض من كلوريد الفضة.
بعد الغسل النهائي وترسيب كلوريد الفضة، تمت إضافة حبيبات الزنك إلى الراسب مع حمض الهيدروكلوريك، مما عزز تكوين الفضة (2):
2AgCl↓ + Zn → ZnCl 2 + 2Ag↓ (2)
بعد إضافة حمض النيتريك المخفف إلى الفضة الناتجة، تتشكل نترات الفضة وينطلق الغاز (3):
3Ag + 4HNO 3 (ديل) → 3AgNO 3 + NO + 2H 2 O (3)
وبعد تبخر نترات الفضة، في حالة فيلم الأشعة السينية، كانت كتلتها 1.2 جرام. وفي حالة الفيلم الفوتوغرافي، كانت كتلة نترات الفضة 0.8 جرام.
3.2 نتائج الحصول على نترات الفضة من المنتجات المحتوية على الفضة
2Cu(NO 3)2 → 2CuO↓+4NO 2 +O 2 (4).
أرز. 11. تبخر محلول أملاح الفضة والنحاس.
وبعد إضافة الماء، تذوب نترات الفضة، ويظل أكسيد النحاس راسبًا. تم سكب المحلول الناتج في زجاجة تحمل اسم AgNO 3.
3.3 نتائج التفاعلات النوعية على أيونات الهاليد مع نترات الفضة الناتجة
بعد إضافة نترات الفضة إلى محاليل الأملاح التي تحتوي على أيونات الكلوريد، تتشكل أيونات البروميد وأيونات اليوديد والأبيض (5) والأصفر الفاتح (6) والرواسب الصفراء (7) على التوالي (الشكل 9):
Cl - + AgNO 3 → AgCl↓ + NO - 3 (5)
ر - + AgNO 3 → AgBr↓ + NO - 3 (6)
أنا - + AgNO 3 → AgI↓ + NO - 3 (7).
أرز. 9. ردود الفعل النوعية لأيونات الهاليد. أ. أيونات الكلوريد. ب. أيونات البروميد. ب. أيونات اليوديد
3.4 نتائج تفاعل "المرآة الفضية".
بعد إضافة الجلوكوز إلى محلول أمونيا الفضة وتسخين الخليط يتكون راسب من الفضة على جدران أنبوب الاختبار (8):
HOCH 2 (CHOH) 4 HC=O + 2OH →
HOCH 2 (CHOH) 4 COOH + 2Ag↓ + 3NH 3 + H 2 O (8)
وهذا يشير إلى أن الدراسة أنتجت بالفعل نترات الفضة.
الاستنتاجات
1. استناداً إلى المصادر الأدبية، فإن المواد الخام لإنتاج نترات الفضة هي الأشعة السينية، والأفلام الفوتوغرافية، وزينة شجرة عيد الميلاد، والمرايا.
2. يتم الحصول على نترات الفضة النقية من الأشعة السينية والأفلام الفوتوغرافية.
3. تبين أن ناتج نترات الفضة الذي يتم الحصول عليه من صور الأشعة السينية أكبر من الناتج الذي يتم الحصول عليه من الأفلام الفوتوغرافية.
4. تم إجراء التفاعلات النوعية باستخدام نترات الفضة الناتجة.
5. إذا كانت هناك حاجة ماسة لذلك، يمكن الحصول على نترات الفضة من مختبر المدرسة.
فهرس
1. Mosina T. A. نترات الفضة للرجعية // افعلها بنفسك. - 1990. - رقم 4. ص141
2. الفوائد الصحية للفضة [مصدر إلكتروني]. - مختبر التجديد - وضع الوصول: http://www.deus1.com/serebro.html
3. الأدوية الفضية [مصدر إلكتروني]. - حراس الصيدلية. - وضع الوصول: http://www.alhimik.ru/apteka/apt2N-Ag.html#4.31
4. خاريتونوف يو. الكيمياء التحليلية. - م: الثانوية العامة 2001.
5. يطلق الكيميائيون على نترات الفضة اللازورد [مصدر إلكتروني]. - فن التصوير . - وضع الوصول: http://premier-foto.ru/books/kvchmutov/khimiki-nazyvayut-lyapis